
| A. | 热稳定性:HF、NH3、SiH4依次增大 | |
| B. | 原子半径:C、Al、K依次增大 | |
| C. | 酸碱性:NaOH、Al(OH)3、Mg(OH)2碱性减弱 | |
| D. | 非金属性:Cl、S、P依次增强 |
分析 A.非金属性越强,对应氢化物的稳定性越强;
B.电子层越多,原子半径越大;
C.金属性越强,最高价氧化物对应水合物的碱性越强;
D.同一周期中,原子序数越大非金属性越强.
解答 解:A.非金属性F>N>Si,则热稳定性:HF、NH3、SiH4依次减弱,故A错误;
B.C、Al、K的电子层逐渐增多,则C、Al、K的原子半径逐渐增大,故B正确;
C.金属性Na>Mg>Al,金属性越强,最高价化合物对应水合物的碱性越强,则碱性:NaOH、Mg(OH)2、Al(OH)3碱性减弱,故C错误;
D.Cl、S、P位于同一周期,原子序数逐渐减小,则非金属性逐渐减弱,故D错误;
故选B.
点评 本题考查原子结构与元素周期律的关系,题目难度不大,明确元素周期律内容为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系.


科目:高中化学 来源: 题型:解答题
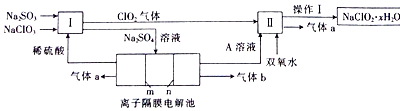
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下6.0g乙酸所含σ键数目为0.8NA | |
| B. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 50mLl2mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
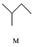 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$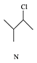 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$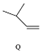 ,下列说法正确的是( )
,下列说法正确的是( )| A. | M的名称为异丁烷 | |
| B. | N的同分异构体有7种(不考虑立体异构,不包括本身) | |
| C. | Q可与溴水反应生成N | |
| D. | M、N、Q均能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-离子的结构示意图: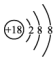 | |
| B. | 甲烷的球棍模型: | |
| C. | H2O2的电子式: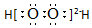 | |
| D. | 碳酸氢钠的电离方程式:NaHCO3═Na++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(g)+3H2(g)?2NH3(g)[在混合气体中φ(NH3)=33.3%] | |
| B. | CO(g)+H2O(g)?CO2(g)+H2(g)(在恒容容器中,容器内压强不再改变) | |
| C. | 2SO2(g)+O2(g)?2SO3(g)(在恒压条件下,总质量不再改变) | |
| D. | 2NO2(g)?2NO(g)+O2(g)(在恒容条件下,气体颜色不再改变) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH计不能用于酸碱中和滴定终点的判断 | |
| B. | 利用太阳能等淸洁能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同 | |
| D. | 葡萄中的花靑素在碱性环境下显蓝色,故可用苏打粉检验假红酒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com