
【题目】在标准状况下,下列四种气体的关系中,从大到小的是
①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3
A. 体积:④>①>②>③
B. 密度:②>③>④>①
C. 质量:②>①>③>④
D. 氢原子数:①>②>③>④
【答案】B
【解析】
在标准状况下
①6.72L CH4,n(CH4)= ![]() =0.3mol;
=0.3mol;
②3.01×1023个HCl分子,n(HCl)=![]() =0.5mol;
=0.5mol;
③13.6g H2S,n(H2S)=![]() =0.4mol;
=0.4mol;
④ NH30.2mol。
A. 由n=![]() ,可以知道,气体的物质的量越大,体积越大,则体积大小关系为②>③>①>④,故A错误;
,可以知道,气体的物质的量越大,体积越大,则体积大小关系为②>③>①>④,故A错误;
B. 由ρ=![]() ,可以知道,气体的摩尔质量越大,则密度越大,密度大小关系为②>③>④>①,故B正确;
,可以知道,气体的摩尔质量越大,则密度越大,密度大小关系为②>③>④>①,故B正确;
C.由n=![]() ,可以知道,m(CH4)=0.3mol×16g/mol=4.8g,m(HCl)=0.5mol×36.5g/mol=18.25g,m(H2S)=13.6g,m(NH3)=0.2mol×17g/mol=3.4g,则质量大小为②>③>①>④,故C错误;
,可以知道,m(CH4)=0.3mol×16g/mol=4.8g,m(HCl)=0.5mol×36.5g/mol=18.25g,m(H2S)=13.6g,m(NH3)=0.2mol×17g/mol=3.4g,则质量大小为②>③>①>④,故C错误;
D.根据氢原子的物质的量的多少判断,物质的量越多,原子个数越多,0.3molCH4含有1.2molH,0.5molHCl含有0.5molH,0.4molH2S含有0.8molH,0.2molNH3含有0.6molH,则氢原子个数大小为①>③>④>②,故D错误;
本题答案为B。


科目:高中化学 来源: 题型:
【题目】下列关于原电池的叙述中错误的是( )
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池是将化学能转变为电能的装置
C.在原电池中,电子流出的一极是负极,发生氧化反应
D.原电池放电时,电流的方向是从正极到负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,下列说法中,正确的是( )
A. 1 mol Cl2作为氧化剂得到的电子数为NA
B. 在0 ℃,101 kPa时,22.4 L氢气中含有NA个氢原子
C. 25 ℃,1.01×105Pa,64 g SO2中含有的原子数为3NA
D. 将0.1 mol FeCl3加到沸水中制得的胶体中,含胶粒0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 同一周期中,第ⅦA族元素的原子半径最大
B. 第ⅥA族元素的原子,其半径越大,越容易得到电子
C. 室温时,0族元素的单质都是气体
D. 同一周期中,碱金属元素的第一电离能最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国华为公司的技术标准成为世界“5G”通讯标准的重要组成部分。随着“5G”时代的逐渐到来,以光导纤维为基础的信息高速通道更显重要。制造光导纤维的材料是( )
A.铜合金B.橡胶C.不锈钢D.二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有硫酸镁溶液500mL,它的密度是1.20g/cm3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是
A. 溶质的质量分数是24.0%
B. 硫酸根离子的质量分数是19.2%
C. 溶液的物质的量浓度是2.4mol/L
D. 溶质和溶剂的物质的量之比是1:40
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3。HA和HB的1L溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是
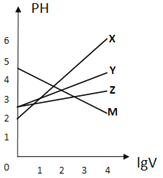
A. 相同条件下,对于c(R-)/[c(HR)·c(OH-)]的值(R代表A或B),一定存在HA>HB
B. 常温下pH:NaA溶液>NaB溶液
C. X是HA,M是HB
D. 若常温下浓度均为0.1mol/L的NaA和HA的溶液等体积混合,则c(A-)+c(HA)=0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】你认为减少酸雨的产生可采取的措施是( )
①用煤作燃料 ②把工厂烟囱造高 ③化石燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源.
A.①②③
B.②③④⑤
C.③⑤
D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要90 mL 3.0mol·L-1 稀硫酸溶液,某同学用质量分数为98%,密度为1.84g/cm3的浓硫酸配制。实验操作如下:
A.将配好的稀硫酸倒入试剂瓶中,贴好标签;
B.盖好容量瓶塞,反复颠倒,摇匀;
C.用量筒量取 mL98%的浓硫酸;
D.将______________沿烧杯内壁慢慢注入盛有少量______________的烧杯中;
E.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液也全部转移到容量瓶中;
F.将已冷却至室温的硫酸溶液沿玻璃棒注入 ;
G.改用 逐滴加蒸馏水,使溶液凹面恰好与刻度相切;
H.继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2 cm处。
(1)填写上述步骤中的空白:
C:________ ;D :将________ 注入________ ;F:________ ;G:_______ 。
(2)将上面操作步骤按正确的进行排序______________(用字母表示)。
(3)试分析下列操作会使所配溶液的浓度偏高的是______________(填序号)。
① 量取浓硫酸时俯视读数;
② 转移溶液前,容量瓶中含有少量蒸馏水;
③ 溶解硫酸用的烧杯、玻璃棒未洗涤;
④ 未冷却至室温定容;
⑤ 定容时俯视容量瓶的刻度线;
⑥ 定容后摇匀,发现液面低于刻度线,再滴加蒸馏水至刻度线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com