
| 分类标准 | 金属单质 | 酸性氧化物 | 碱性氧化物 | 溶液 | 胶体 | 电解质 |
| 属于该类的物质 |
分析 (1)金属元素组成的单质为金属单质,两种元素组成其中一种为氧元素的化合物为氧化物,能和酸反应生成盐和水的氧化物是碱性氧化物,能和碱反应生成盐和水的化合物是酸性氧化物,溶质溶解在溶剂中形成的分散系为溶液,混合物分为胶体、浊液和溶液,电解质为水溶液中或熔融状态能导电的化合物;根据物质的分类标准和物质所属的类别来回答;
(2)离子反应:H++OH-=H2O代表强酸和强碱反应生成易溶于水的盐和水的一类反应;
(3)强电解质在水溶液中能完全电离,根据电离方程式的书写方法来回答;
(4)少量的二氧化碳通入氢氧化钡中生成碳酸钡和水;
(5)氧化还原反应中,化合价升高的元素所在的反应物是还原剂,化合价降低的元素所在的反应物是氧化剂,根据方程式电子转移和化合价升降之间的关系来回答,根据离子方程式的书写知识来书写即可.
解答 解:(1)②是金属元素组成的单质为金属单质;④是能和碱反应生成盐和水的化合物,属于酸性氧化物,③能和酸反应生成盐和水,是碱性氧化物;⑧⑨属于溶液,⑦红褐色的氢氧化铁液体是胶体分散系,③是熔融状态下能导电的化合物,⑤⑥⑩是在水溶液状态下能导电的化合物,属于电解质,故答案为:②;④;③;⑧⑨;⑦;③⑤⑥⑩;
(2)离子反应:H++OH-=H2O代表强酸和强碱反应生成易溶于水的盐和水的一类反应,如Ba(OH)2+2HNO3=Ba(NO3)2+2H2O,故答案为:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
(3)硫酸铝是强电解质,在水溶液中能完全电离,电离方程式为:Al2(SO4)3=2Al3++3SO42-,故答案为:Al2(SO4)3=2Al3++3SO42-;
(4)少量的二氧化碳通入氢氧化钡中生成碳酸钡和水,即Ba2++2OH-+CO2=BaCO3↓+H2O,故答案为:Ba2++2OH-+CO2=BaCO3↓+H2O;
(5)氧化还原反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,化合价升高的Cu元素所在的反应物Cu是还原剂,化合价降低的N元素所在的反应物HNO3是氧化剂,做氧化剂的硝酸是2mol,还原剂金属铜是3mol,所以氧化剂与还原剂的物质的量之比是2:3,有3molCu发生反应时,转移电子的物质的量为6mol,有3.2g即0.05molCu发生反应时,转移电子的物质的量为0.1mol,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:HNO3;2:3;0.1mol;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
点评 本题涉及物质的分类、物质的电离方程式、离子方程式的书写等知识的考查,注意知识的归纳和梳理是解题的关键,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
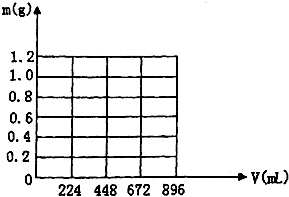 将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况,以下情况相同.)
将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况,以下情况相同.)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可燃冰是可以燃烧的冰 | |
| B. | 明矾的化学式:KAl(SO4)2 | |
| C. | 酒精、水玻璃、福尔马林都是非电解质 | |
| D. | 肽键是蛋白质一级结构中的主键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其他 | 常温下该单质为黄色固体 | 无机非金属材料的主角 | 焰色反应呈黄色 | 其氧化物可做耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 ,其反应类型是消去反应.
,其反应类型是消去反应. .
.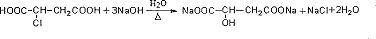 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应均是自发反应 | |
| B. | 如果△H和△S为均正值,当高温时,反应可能自发进行 | |
| C. | 物质的量增加的反应,△S为正值 | |
| D. | △S为正值的反应均是自发反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(g);△H1 2H2(g)+O2(g)═2H2O(l);△H2 | |
| B. | S(s)+O2═SO2(g);△H1 S(g)+O2═SO2(g);△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g);△H1$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
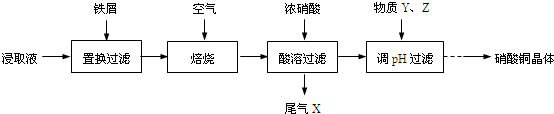
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 该有机物的分子式为C6H8O2,属于芳香烃 | |
| B. | 该有机物能与FeCl3溶液发生显色反应 | |
| C. | 该有机物中所有原子不可能在同一平面 | |
| D. | 1mol该有机物与足量的Na反应可产生1molH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com