
下列事实不能说明醋酸是弱电解质的是( )
A.0.1 mol·L-1醋酸的pH比0.1 mol·L-1盐酸的pH大
B.醋酸能和碳酸钙反应放出CO2
C.0.1 mol·L-1醋酸钠溶液的pH=8.9
D.大小相同的锌粒分别与相同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢
科目:高中化学 来源:2014高考化学名师知识点精编 专题11电化学练习卷(解析版) 题型:选择题
如图装置中,小试管内为红墨水,带有支管的U形管中盛有pH=4的雨水和生铁片。经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U形管中的液面。以下有关解释合理的是( )
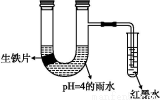
A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片始终发生析氢腐蚀
C.墨水液面回升时,正极反应式为:O2+2H2O+4e-=4OH-
D.U形管中溶液pH逐渐减小
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题9电化学原理练习卷A(解析版) 题型:选择题
根据图所示装置,下列说法不正确的是( )
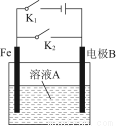
选项开关状态溶液A电极B说明
A打开K1,闭合K2NaCl石墨正极反应:O2+2H2O+4e-=4OH-
B打开K1,闭合K2NaClZn铁制品保护:牺牲阳极的阴极保护法
C打开K2,闭合K1CuSO4Cu铁表面镀铜
D打开K2,闭合K1CuSO4粗铜电解法精炼铜
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(解析版) 题型:填空题
工业上将制取重铬酸钾(K2Cr2O7)和铬酸酐(CrO3)的剩余废渣称为铬渣,其成分为SiO2、Al2O3、MgO、Fe2O3、CrO3、K2Cr2O7等。
已知:
①重铬酸钾和铬酸酐都易溶于水,这是造成铬污染的主要原因,它们都是强氧化剂,铬酸酐溶于水呈酸性;
②+6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。
③下表为一些金属氢氧化物沉淀的pH参照数据。
物质 | 开始沉淀 | 完全沉淀 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.7 | 4.7 |
Cr(OH)3 | 4.7 | a |
Fe(OH)2 | 7.6 | 9.6 |
Mg(OH)2 | 9.6 | 11.1 |
回答下列处理铬渣、消除铬污染的有关问题:
(1)将铬渣用稀硫酸浸取、过滤,在浸出液中加入适量的绿矾(FeSO4·7H2O),加入绿矾的目的是_____________________________________________
(2)再向浸出液中缓慢加入烧碱,至pH刚好达到4.7,过滤,所得沉淀的化学式是____________________________________________________________;
常温下,Cr(OH)3的溶度积Ksp=10-32,要使Cr3+完全沉淀[c(Cr3+)降至10-5 mol·L-1视为沉淀完全],溶液的pH应调于a=________。
(3)向(2)中得到的滤液中加入硫酸,调节至呈强酸性,所得的溶液是含____________________溶质的溶液。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷B(解析版) 题型:选择题
含Cd2+废水可通过如下反应转化为CdS,以消除镉对环境的污染:
Cd2+(aq)+H2S(g) CdS(s)+2H+(aq) ΔH<0
CdS(s)+2H+(aq) ΔH<0
该反应达到平衡后,改变横坐标表示的条件,下列示意图正确的是( )
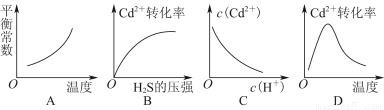
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷A(解析版) 题型:选择题
某研究性活动小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O NH4HCO3+NH3·H2O,经测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是( )
NH4HCO3+NH3·H2O,经测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是( )
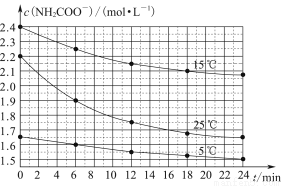
A.0~12 min,初始浓度越大的实验,水解反应速率越大
B.c(NH2COO-)将随反应时间的不断延长而一直减小至0
C.25 ℃时0~6 min,v(NH2COO-)为0. 05 mol·L-1·min-1
D.15 ℃时,第30 min时,c(NH2COO-)为2.0 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题6物质结构与元素周期律练习卷(解析版) 题型:选择题
下列变化需克服相同类型作用力的是( )
A.碘和干冰的升华 B.硅和C60的熔化
C.氯化氢和氯化钠的溶解 D.溴和汞的汽化
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题16物质结构与性质练习卷(解析版) 题型:填空题
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。
(1)①H、C、N、O四种元素的电负性由小到大的顺序为____________。
②下列叙述不正确的是________。(填字母)
A.因为HCHO与水分子间能形成氢键,所以CH2O易溶于水
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个σ键和1个大π键,C2H2是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式________。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是________________________________________________________________________。
②六氰合亚铁离子[Fe(CN)6]4 -中不存在________。
A.共价键 B.非极性键 C.配位键
D.σ键 E.π键
写出一种与 CN-互为等电子体的单质的分子式________。
(3)根据元素原子的外围电子排布特征,可将周期表分成五个区域,其中Ti属于________区。
(4)一种Al—Fe合金的立体晶胞如图所示。请据此回答下列问题:
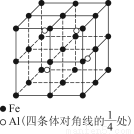
①确定该合金的化学式____________。
②若晶体的密度为ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为__________cm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com