
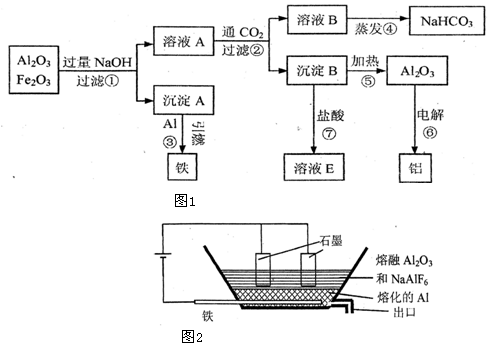
分析 由流程图可知:铝土矿主要成份为氧化铝,杂质主要是氧化铁,加入过量氢氧化钠,氧化铁不溶,则沉淀A为氧化铁,与Al发生铝热反应制得铁,氧化铝与NaOH反应Al2O3+2NaOH═2NaAlO2+H2O而溶解,得到溶液A的主要成分为偏铝酸钠和氢氧化钠,通入足量的二氧化碳,发生反应:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,NaOH+CO2+H2O=NaHCO3,溶液B为碳酸氢钠溶液,沉淀B为Al(OH)3,与盐酸反应生成氯化铝,灼烧生成氧化铝,氧化铝电解得铝单质,据此分析解答.
解答 解:(1)氧化铁不溶于氢氧化钠,沉淀A为Fe2O3,氧化铝与NaOH反应而溶解,氢氧化钠过量,则得到溶液A的主要成分为NaAlO2和NaOH;
故答案为:Fe2O3;NaAlO2和NaOH;
(2)沉淀B为Al(OH)3,与盐酸反应生成氯化铝,铝离子水解溶液显酸性;溶液B为碳酸氢钠溶液,碳酸氢根离子水解,HCO3-+H2O?H2CO3+OH-,溶液显碱性;
故答案为:酸;HCO3-+H2O?H2CO3+OH-;
(3)经分析知反应①为氧化铝与氢氧化钠反应:Al2O3+2NaOH═2NaAlO2+H2O;反应③铝热反应:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;反应⑦为氢氧化铝与盐酸的反应:Al(OH)3+3HCl=AlCl3+3H2O;
故答案为:Al2O3+2NaOH═2NaAlO2+H2O;Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;Al(OH)3+3HCl=AlCl3+3H2O;
(4)由图可知,石墨电极连接电源的正极,作阳极,阳极发生氧化反应,铝在高温下与水反应,故不能用水冷却熔化的铝;
故答案为:阳极;氧化;否.
点评 本题考查物质的制备,为高频考点,把握实验流程中的反应及分离方法为解答的关键,注意氧化铝、氢氧化铝两性的分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 向一定量石灰石中滴加稀盐酸 | 向一定量硫酸铜溶液中不断加入铁粉 | 向足量盐酸中加等量的金属Zn、Fe | 向一定量过氧化氢溶液中加入少量二氧化锰 |
 |  |  | 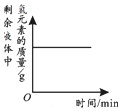 |
| A. | A | B. | B | C. | C | D. | DA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用饱和食盐水和稀硫酸为原料制取HCl | |
| B. | 用大理石和稀硫酸制取CO2 | |
| C. | 用铁和盐酸为原料制取H2 | |
| D. | 用双氧水和二氧化锰为原料制取O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉、漂粉精可用于饮用水及餐具等的消毒 | |
| B. | 福尔马林可用于食品的消毒,如浸泡海鲜,使其不易变质 | |
| C. | 药用酒精可用于食物及饮用水消毒 | |
| D. | 过氧乙酸无须稀释可直接使用消毒,不会对人体造成伤害 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

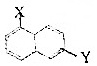 和
和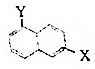
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若在阴极附近的溶液中滴入紫色石蕊试液,溶液呈红色 | |
| B. | 若在阳极附近的溶液中滴入KI溶液,溶液呈棕色 | |
| C. | 电解时在阳极得到氯气,在阴极得到金属钠 | |
| D. | 电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液变回NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量的烧碱溶液与二氧化碳的反应:OH-+CO2═HCO3- | |
| B. | 盐酸溶液与硝酸银溶液反应:HCl+Ag+═AgCl↓+H+ | |
| C. | 向Na2SiO3溶液中通入少量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若容器中密度不变则说明达到化学平衡状态 | |
| B. | A平衡转化率为60% | |
| C. | 平衡常数为$\frac{4}{9}$ | |
| D. | 平衡时D的体积分数25% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:H2>Li | B. | H-与Li+的电子层结构相同 | ||
| C. | 微粒半径:r(H-)>r(H)>r(H+) | D. | LiH属于离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com