
| A£® | TiCl4ŌŚ·“Ó¦IÖŠŹĒ»¹Ō²śĪļ£¬ŌŚ·“Ó¦¢ņÖŠŹĒŃõ»Æ¼Į | |
| B£® | C”¢MgŌŚ·“Ó¦ÖŠ¾łĪŖ»¹Ō¼Į£¬±»Ńõ»Æ | |
| C£® | ĆæÉś³É19.2 g Ti£¬·“Ó¦¢ń”¢¢ņÖŠ¹²×ŖŅĘ1.6 mol e- | |
| D£® | ·“Ó¦IÖŠb=c=2£¬·“Ó¦IIÖŠMgµÄ»¹ŌŠŌ“óÓŚTi |
·ÖĪö ·“Ó¦¢ńÖŠTiŌŖĖŲ»ÆŗĻ¼Ū²»±ä£¬ClŌŖĖŲ»ÆŗĻ¼Ū½µµĶ£¬ĀČĘųĪŖŃõ»Æ¼Į£¬CŌŖĖŲ»ÆŗĻ¼ŪÉżøߣ¬±»Ńõ»Æ£¬CĪŖ»¹Ō¼Į£¬¢ņÖŠTiŌŖĖŲ»ÆŗĻ¼Ū½µµĶ£¬±»»¹Ō£¬TiCl4ĪŖŃõ»Æ¼Į£¬MgĪŖ»¹Ō¼Į£¬½įŗĻÖŹĮæŹŲŗć¶ØĀÉŅŌ¼°Ńõ»Æ»¹Ō·“Ó¦µĆŹ§µē×ÓŹżÄæĻąµČµÄ¹ęĀɽā“šøĆĢā£®
½ā“š ½ā£ŗA£®aTiO2+bCl2+cC$\frac{\underline{\;1173K\;}}{\;}$aTiCl4+cCOøĆ·“Ó¦ÖŠ·“Ó¦Ē°ŗó£¬Ģ¼ŌŖĖŲµÄ»ÆŗĻ¼ŪÉżøߣ¬Ģ¼µ„ÖŹ×÷»¹Ō¼Į£¬ĀČŌŖĖŲµÄ»ÆŗĻ¼Ū½µµĶ£¬ĀČĘų×÷Ńõ»Æ¼Į£¬»¹Ō²śĪļŹĒTiCl4£»
TiCl4+2Mg$\frac{\underline{\;1220K”«1420K\;}}{\;}$Ti+2MgCl2øĆ·“Ó¦ÖŠīŃŌŖĖŲµÄ»ÆŗĻ¼Ū½µµĶ£¬TiCl4×÷Ńõ»Æ¼Į£»ĖłŅŌTiCl4ŌŚ·“Ó¦IÖŠŹĒ»¹Ō²śĪļ£¬ŌŚ·“Ó¦IIÖŠŹĒŃõ»Æ¼Į£¬¹ŹAÕżČ·£»
B£®C”¢MgŌŚ·“Ó¦ÖŠ·“Ó¦Ē°ŗó»ÆŗĻ¼Ū¶¼Éżøߣ¬ĖłŅŌ¾łĪŖ»¹Ō¼Į£¬±»Ńõ»Æ£¬¹ŹBÕżČ·£»
C£®½«·½³ĢŹ½¢ń”¢¢ņĻą¼ÓµĆ TiO2+2Cl2+2C+2Mg=Ti+2CO+2MgCl2 ×ŖŅʵē×Ó
48g 8mol
19.2g 3.2mol
ĖłŅŌĆæÉś³É19.2 g Ti£¬·“Ó¦I”¢IIÖŠ¹²×ŖŅĘ3.2 mol e-£¬¹ŹC“ķĪó£»
D£®øł¾Ż·“Ó¦Ē°ŗóø÷ŌŖĖŲµÄŌ×ÓøöŹżŹŲŗćÖŖ£¬2a=c£¬2b=4a£¬Ōņa=1”¢b=c=2£¬·“Ó¦IIÖŠMgÄÜ»¹ŌTiCl4£¬ĖłŅŌĆ¾µÄ»¹ŌŠŌ“óÓŚTi£®
¹ŹŃ”C£®
µćĘĄ ±¾Ģāæ¼²éŃõ»Æ»¹Ō·“Ó¦µÄ¼ĘĖć£¬²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦ŗĶ¼ĘĖćÄÜĮ¦µÄ漲飬ÄŃ¶Č²»“ó£¬×¢Ņā»ł±¾øÅÄīµÄĄķ½ā”¢Ńõ»Æ»¹Ō·“Ó¦ÖŠµĆŹ§µē×ÓĻąµČµČĪŹĢā£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
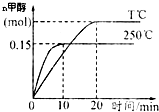 ½«1molCOŗĶ2molH2³äČėŅ»ČŻ»żĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ£¬·Ö±šŌŚ250”ę”¢T”ę·¢Éś·“Ó¦£ŗCO£Øg£©+2H2£Øg£©?CH3OH£Øg£©”÷H=akJ/mol£¬øł¾ŻĶ¼Ź¾ÅŠ¶Ļ£¬ĻĀĮŠ½įĀŪÕżČ·µÄŹĒ£Ø””””£©
½«1molCOŗĶ2molH2³äČėŅ»ČŻ»żĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ£¬·Ö±šŌŚ250”ę”¢T”ę·¢Éś·“Ó¦£ŗCO£Øg£©+2H2£Øg£©?CH3OH£Øg£©”÷H=akJ/mol£¬øł¾ŻĶ¼Ź¾ÅŠ¶Ļ£¬ĻĀĮŠ½įĀŪÕżČ·µÄŹĒ£Ø””””£©| A£® | a£¼0£¬T£¼250 | |
| B£® | 250”ꏱ£¬0”«10minÄŚ£ŗv£ØH2£©=0.015mol/£ØL•min£© | |
| C£® | COµÄĘ½ŗā×Ŗ»ÆĀŹŌŚ250”ꏱ±ČT”ę“ó | |
| D£® | 250”ꏱ£¬ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠøijä1molCH3OHĘųĢ壬ŗćĪĀ“ļĘ½ŗāŗó£¬CH3OHµÄĪļÖŹµÄĮæ“óÓŚ0.15mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĀČ»ÆĆ¾¾§ĢåŠčŌŚĀČ»ÆĒāĘųĮ÷µÄ·ÕĪ§ÖŠ¼ÓČČŹ§Ė®ÖʵĆĪŽĖ®ĀČ»ÆĆ¾ | |
| B£® | ĻÄĢģ£¬“ņæŖĢ¼ĖįŅūĮĻ»įÓŠ½Ļ¶ąĘųÅŻŅē³ö | |
| C£® | ŹµŃéŹŅÖŠ³£ÓĆÅű„ŗĶŹ³ŃĪĖ®µÄ·½·ØŹÕ¼ÆĀČĘų | |
| D£® | ¹¤ŅµÉĻÉś²ś°±ĘųŹ±£¬²ÉÓĆøßĪĀŗĶ“߻ƼĮµČĢõ¼ž |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
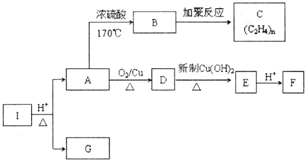 »ÆŗĻĪļIµÄ·Ö×ÓŹ½ĪŖC6H10O4£¬75%µÄAČÜŅŗ³£ÓĆÓŚŅ½ĮĘĻū¶¾£¬ÓėIĻą¹ŲµÄ·“Ó¦ČēĶ¼£®øł¾ŻŅŌÉĻŠÅĻ¢»Ų“šĻĀĮŠĪŹĢā£®
»ÆŗĻĪļIµÄ·Ö×ÓŹ½ĪŖC6H10O4£¬75%µÄAČÜŅŗ³£ÓĆÓŚŅ½ĮĘĻū¶¾£¬ÓėIĻą¹ŲµÄ·“Ó¦ČēĶ¼£®øł¾ŻŅŌÉĻŠÅĻ¢»Ų“šĻĀĮŠĪŹĢā£® £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 3£ŗ3£ŗ2 | B£® | 5£ŗ5£ŗ4 | C£® | 2£ŗ2£ŗ3 | D£® | 1£ŗ1£ŗ1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ŅŃÖŖ£ŗ¢ŁCH4£Øg£©+H2O£Øg£©ØTCO£Øg£©+3H2£Øg£©”÷H=+206.2kJ/mol
ŅŃÖŖ£ŗ¢ŁCH4£Øg£©+H2O£Øg£©ØTCO£Øg£©+3H2£Øg£©”÷H=+206.2kJ/mol| ĪĀ¶Č£Ø”ę£© | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| Ę½ŗāĘųĢå×ÜÅØ¶Č£Ø”Į10-3mol/L£© | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÄąĖ® | B£® | ŃĪĖį | C£® | Fe£ØOH£©3½ŗĢå | D£® | NaClČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ²»É÷½«ÅؼīČÜŅŗÕ“µ½Ę¤·ōÉĻ£¬Į¢¼“ÓĆ“óĮæĮņĖį³åĻ“£¬Č»ŗóŌŁÓĆĖ®³åĻ“ | |
| B£® | ²»É÷½«Ėį½¦µ½ŃŪÖŠ£¬Į¢¼“ÓĆ“óĮæĖ®³åĻ“£¬±ßĻ“±ßÕ£ŃŪ¾¦ | |
| C£® | ŹµŃ鏱ŹÖÖøÉĻ²»Š”ŠÄÕ“ÉĻÅØĮņĖį£¬Į¢¼“ÓĆNaOHČÜŅŗĒåĻ“ | |
| D£® | ¾Ę¾«²»É÷Č÷ŌŚŹµŃéץÉĻÉÕĘšĄ“Ź±£¬Į¢¼“ÓĆĖ®½½Ćš |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
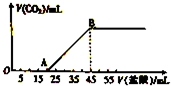 ½«5.08gÓÉNa2CO3ŗĶNaHCO3×é³ÉµÄ¹ĢĢå»ģŗĻĪļĶźČ«ČÜÓŚĖ®£¬ÖĘ³ÉČÜŅŗ£¬Č»ŗóĻņøĆČÜŅŗÖŠÖšµĪ¼ÓČė2mol?L-1µÄŃĪĖį£¬Ėł¼ÓČėŃĪĖįµÄĢå»żÓė²śÉśCO2Ģå»ż£Ø±ź×¼×“æö£©µÄ¹ŲĻµČēĶ¼ĖłŹ¾£®
½«5.08gÓÉNa2CO3ŗĶNaHCO3×é³ÉµÄ¹ĢĢå»ģŗĻĪļĶźČ«ČÜÓŚĖ®£¬ÖĘ³ÉČÜŅŗ£¬Č»ŗóĻņøĆČÜŅŗÖŠÖšµĪ¼ÓČė2mol?L-1µÄŃĪĖį£¬Ėł¼ÓČėŃĪĖįµÄĢå»żÓė²śÉśCO2Ģå»ż£Ø±ź×¼×“æö£©µÄ¹ŲĻµČēĶ¼ĖłŹ¾£®²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com