
(1)请设计配制方案。
(2)如果要求尽可能多地使用现有食盐溶液,应怎样设计实验方案。
(1)①只用食盐晶体和水配制 ②将15%的食盐溶液全部用上 ③将40%的食盐溶液全部用上 ④两种溶液各用10 g,再加食盐晶体和水(多种方案,只要选用其中一种合理方案就可给分)
(2)设需15%的食盐溶液质量为x,需40%的食盐溶液质量为y,则有x+y=30%;
x×15%+y×40%=30 g×20%,得x=24 g>20 g,y=6 g。
要尽可能多地使用现有食盐溶液,必须把15%的溶液全部用上,再加适量水和40%的食盐溶液,设还需要40%的食盐溶液的质量为w,水的质量为z,则有:
20 g+w+z=30 g
20 g×15%+w×40%=30 g×20%
解得w=7.5 g,z=2.5 g


科目:高中化学 来源:无锡二模 题型:问答题

查看答案和解析>>
科目:高中化学 来源: 题型:
(1)试选择多种可能的配制方法(至少四种)。
(2)若要求尽可能多地使用现有的食盐水,应如何配制?
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)
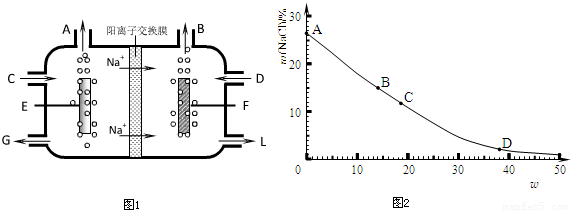
 食盐不仅是生活必需品,也是生产氯气和烧碱的重要原料。下图1是工业电解饱和食盐水的离子交换膜电解槽示意图。
食盐不仅是生活必需品,也是生产氯气和烧碱的重要原料。下图1是工业电解饱和食盐水的离子交换膜电解槽示意图。
(1)B处出口产生的物质是 ▲ ;C处进口的物质是 ▲ 。
(2) ▲ 离子被阳离子交换膜阻止进入阳极区,原因是 ▲ 。
(3)如图2所示,20℃时在混合溶液中,
随着氢氧化钠含量的变化,氯化钠达
 到饱和状态时其溶质质量分数的变化曲线。已知曲线上A、B、C、D四个点的坐标分别为:A(0,26.5);B(14.0,15.0);C(18.8,11.7);D(38.0,2.0)。
到饱和状态时其溶质质量分数的变化曲线。已知曲线上A、B、C、D四个点的坐标分别为:A(0,26.5);B(14.0,15.0);C(18.8,11.7);D(38.0,2.0)。
① 20℃时,氯化钠在水中的溶解度为 ▲ g。
② D点处氢氧化钠的物质的量浓度约为多大?(已知D点处溶液的密度约为1.4g·mL―1,计算结果保留两位有效数字)
▲
③ 若现有20℃时,满足曲线上B点指标的溶液,可用 ▲ 方法尽可能地降低氯化钠的含量,达到提纯氢氧化钠的目的。
查看答案和解析>>
科目:高中化学 来源:2013年高考化学备考复习卷1:物质的分类 分散系(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com