
【题目】运用有关概念判断下列叙述正确的是( )
A.1mol H2燃烧放出的热量为H2的燃烧热
B.Na2SO3和H2O2的反应为氧化还原反应
C.![]() 和
和![]() 互为同系物
互为同系物
D.BaSO4的水溶液不导电,故BaSO4是弱电解质
科目:高中化学 来源: 题型:
【题目】下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
A.亚硫酸氢钠和硫酸氢钠分别溶解在水中
B.硝酸铵与硝酸分别受热变为气体
C.氯化钠与氯化氢分别溶解在水中
D.碘与干冰分别受热变为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应由两步反应A![]() B
B![]() C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )
C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )

A.三种化合物的稳定性顺序:B﹤A﹤CB.两步反应均为放热反应
C.加入催化剂会改变反应的焓变D.A![]() C的反应的ΔH=E1-E2
C的反应的ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
![]() (g)
(g)![]()
![]() (g)+H2(g) △H
(g)+H2(g) △H
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ/mol | 412 | 348 | 612 | 436 |
计算上述反应的△H=________ kJ·mol-1。
(2)500℃时,在恒容密闭容器中,充入a mol乙苯,反应达到平衡后容器内气体的压强为P;若再充入bmol的乙苯,重新达到平衡后容器内气体的压强为2P,则a_______b(填“>” “<”或“=”),乙苯的转化率将________(填“增大” “减小”或“不变”)。
(3)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
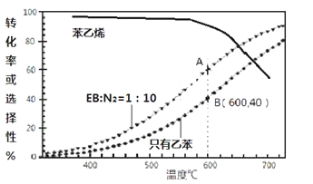
①A,B两点对应的正反应速率较大的是________。
②掺入N2能提高乙苯的平衡转化率,解释说明该事实___________________________。
③用平衡分压代替平衡浓度计算600℃时的平衡常数Kp=________。(保留两位有效数字,分压=总压×物质的量分数)
④控制反应温度为600℃的理由是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氯元素比硫元素非金属性强,某化学实验小组设计如下实验,请回答下列问题:

(1)A中药品足量,发生的化学反应方程式____,当生成2.24 L Cl2(标况)时,被氧化的浓盐酸的物质的量为____;
(2)B中试剂为_______,该装置的作用是_______;
(3)C中盛有硫化钾溶液,该装置的现象是______;
(4)在D的KI溶液中添加少量_____,通过观察到________的现象,可以证明氯元素的非金属性大于碘元素。指出整个实验设计的不足之处_____;
(5)请阅读下列信息:
①硫化氢的水溶液酸性比氯化氢的弱 ②S2Cl2分子中氯元素显-1价 ③铜和氯气在加热条件下反应生成氯化铜,铜和硫在加热条件下反应生成硫化亚铜 ④沸点:硫磺>氯气 ⑤高氯酸的酸性大于硫酸
能证明氯元素的非金属性比硫元素强的是______(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.酸性碘化钾溶液中滴加适量双氧水:2I-+2H++H2O2=I2+2H2O
B.用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
C.向苯酚钠溶液中通入少量CO2,溶液变浑浊:2![]() +CO2+H2O=2
+CO2+H2O=2![]() +CO32-
+CO32-
D.铅蓄电池充电时阴极反应式:PbSO42e-+2H2O=PbO2+SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是( )

A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液pH逐渐降低
C. K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D. K2闭合,电路中通过0.4NA个电子时,两极共产生4.48L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《自然》杂志曾报道我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。完成下列填空:
(1)l0Be和9Be___(填序号)。
a.是同一种原子 b.具有相同的中子数
c.具有相同的化学性质 d.互为同位素
(2)写出A1(OH)3与NaOH溶液反应的化学方程式:___。
(3)研究表明28A1可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是__(填序号)。
a.比较Mg(OH)2与A1(OH)3的碱性强弱
b.比较这两种元素的最高正化合价
c.将打磨过表面积相同的镁条和铝片分别和100℃热水作用,并滴入酚酞溶液
d.比较这两种金属的硬度和熔点
(4)目前还有一种测量方法叫“钾氩测年法”。
两种常见简单阴离子的核外电子排布与Ar相同,两者的半径大小关系为:___(用化学符号表示);其中一种离子与钾同周期相邻元素的离子所形成的化合物可用作干燥剂,用电子式表示该物质的形成过程:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W是一种医药化工合成中间体,其合成路线如下:
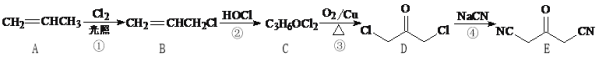
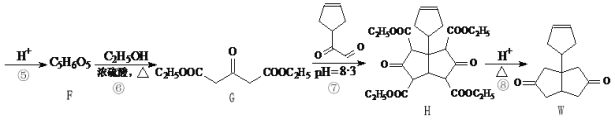
(1)B中官能团的名称是________和_________。
(2)反应④的反应类型是________。
(3)F的结构简式是_________。
(4)芳香化合物X是W的同分异构体,X能够发生银镜反应,核磁共振氢谱有五组峰,峰面积之比为6:4:3:2:1,写出X的一种结构简式:________。
(5)写出以1,2-二氯乙烷和![]() 为原料合成
为原料合成![]() 的合成路线流程图(无机试剂可任选)_________________。合成路线流程图示例如下:
的合成路线流程图(无机试剂可任选)_________________。合成路线流程图示例如下:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com