
(11分) 已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
请回答以下问题:
电解时,粗铜应与电源的 极相连。阴极上的电极反应式为 。
电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl— = AuCl4— | >>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因: 。
(2)滤液含量的测定:
以下是该小组探究滤液的一个实验流程:
则100mL滤液中Cu2+的浓度为 mol·L—1 ,Fe2+的浓度为 mol·L—1
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:


 试推测叔丁醇是否能发生类似反应
试推测叔丁醇是否能发生类似反应



查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省高三上学期第二次综合考试化学试卷 题型:实验题
(11分) 已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
请回答以下问题:
电解时,粗铜应与电源的 极相连。阴极上的电极反应式为 。
电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
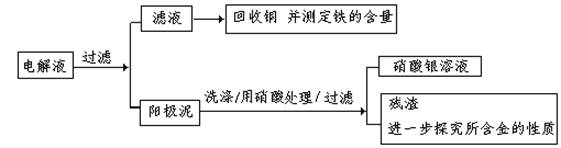
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
|
序号 |
反应 |
平衡常数 |
|
1 |
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
|
2 |
Au3+ + 4Cl— = AuCl4— |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因: 。
(2)滤液含量的测定:
以下是该小组探究滤液的一个实验流程:
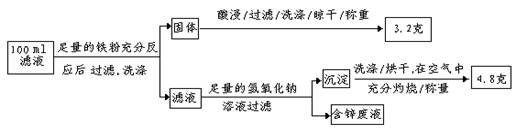
则100mL滤液中Cu2+ 的浓度为 mol·L—1 ,Fe2+的浓度为 mol·L—1
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省高三高考模拟考试(理综)化学部分 题型:填空题
(13分)Ⅰ.一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g) Ni(CO)4(g) 该反应的ΔH
▲ 0 (选填“>”或“=”或“<”)。
Ni(CO)4(g) 该反应的ΔH
▲ 0 (选填“>”或“=”或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g) ΔH2=+ 172.5 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH3=-296.0 kJ·mol-1
请写出CO除SO2的热化学方程式 ▲ 。
(3)下图中左图是一碳酸盐燃料电池,它以CO为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质,右图是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:
①写出A极发生的电极反应式 ▲ 。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与 ▲ 极 (填:“C”或“D”)相连。
③当消耗2.24 L(标况下)CO时,粗铜电极理论上减少铜的质量 ▲ (填:“大于”、“等于” 或“小于”)6.4克。

Ⅱ.(1)已知Na2CrO4溶液酸化时发生的反应为:2CrO42-+2H+Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55 mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH= ▲ 。
(2)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 ▲ mol·L-1,然后再进行后续处理方能达到国家排放标准。
②还原法:CrO42- Cr3+
Cr3+ Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。
Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源:2012届江西省高安中学高三上学期第二次综合考试化学试卷 题型:实验题
(11分) 已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。某化学兴趣小组在实 验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
请回答以下问题:
电解时,粗铜应与电源的 极相连。阴极上的电极反应式为 。
电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理: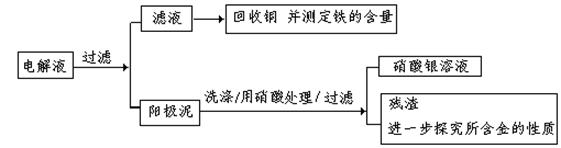
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl— =" " AuCl4— | >>1 |
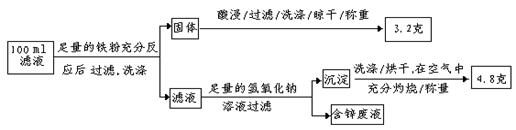
 :
:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com