
|
| 1×10-14 |
| 10-9 |


科目:高中化学 来源: 题型:
| A、H2SO3在水溶液中的电离方程式:H2SO3═2H++SO32- |
| B、CO32-在水溶液中的水解方程式:CO32-+2H2O═H2CO3+2OH- |
| C、碳酸钙溶于盐酸中:CO32-+2H+=H2O+CO2↑ |
| D、Al3+在水溶液中的水解方程式:Al3++3H2O?Al(OH)3+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
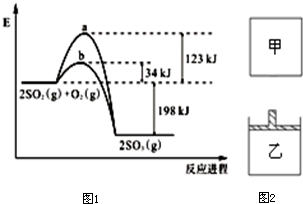 已知 2mol SO2(g)氧化为2mol SO3(g) 的能量变化如图1所示:
已知 2mol SO2(g)氧化为2mol SO3(g) 的能量变化如图1所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如右下图所示装置.试回答下列问题:
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如右下图所示装置.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H2 C6H6 |
| B、CH4 C3H8 |
| C、C3H6 C3H8 |
| D、C2H4 C4H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有大量的氯气泄漏时,可在现场喷洒NaOH溶液 |
| B、金属钠着火燃烧时,用泡沫灭火器灭火 |
| C、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
| D、含硫酸的废液倒入水槽,用水冲入下水道 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②① | B、仅① | C、①② | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com