
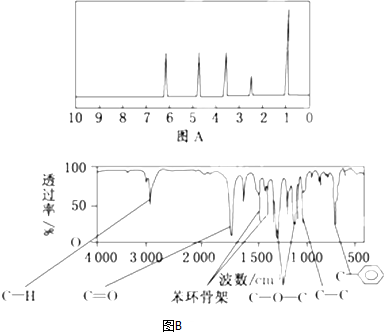
| 72%×150 |
| 12 |
| 6.67%×150 |
| 1 |
| (1-72%-6.67%)×150 |
| 16 |


科目:高中化学 来源: 题型:
| A、W、M的某种单质可作为水处理中的消毒剂 |
| B、电解YW2的熔融物可制得Y和W的单质 |
| C、相同条件下,W的氢化物水溶液酸性比Z弱 |
| D、X、M两种元素形成的一种化合物与水反应可生成M的某种单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液态钠可用作核反应堆的传热介质 |
| B、在过渡元素中找寻半导体材料 |
| C、考古时利用l4C测定一些文物的年代 |
| D、SiO2是制造水泥、人造宝石、单晶硅的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
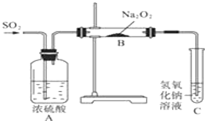 有两个实验小组探究Na2O2与SO2的反应,都用如图所示装置进行实验.
有两个实验小组探究Na2O2与SO2的反应,都用如图所示装置进行实验.
查看答案和解析>>
科目:高中化学 来源: 题型:
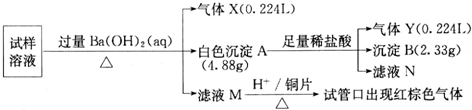
查看答案和解析>>
科目:高中化学 来源: 题型:
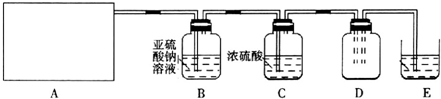
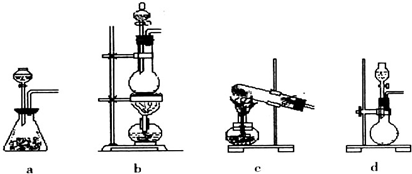
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量洗气瓶B中溶液于试管Ⅰ中,滴加 | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42-. |
| 步骤2:另取适量洗气瓶B中溶液于试管Ⅱ中,滴加 过量Ba(NO3)2溶液振荡,静置. | 产生白色沉淀. |
| 步骤3:取步骤2后试管Ⅱ中的上层清液于试管Ⅲ中,滴加 | 若产生白色沉淀,则洗气瓶B溶液中存在Cl- |
| 实验步骤 | 实验操作 | ||||
| Ⅰ | 取少量质量的FeCO2固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 | ||||
| Ⅱ | 取少量实验步骤Ⅰ所得固体放于一洁净的试管中,用足量的稀硫酸溶解 | ||||
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 | ||||
甲同学的结论:4FeCO3+O2
| |||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在5 min 内该反应用C的浓度变化表示的反应速率为0.02 mol/(L?min) |
| B、5 min 时,容器内D的浓度为0.2 mol/L |
| C、该可逆反应随反应的进行,容器内压强逐渐增大 |
| D、5 min时容器内气体总的物质的量为3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
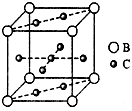 A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kj/mol)分别为:578、1 817、2 745、ll 575;E与F能形成原子数目 比为1:3、熔点为190℃的化合物Q.
A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kj/mol)分别为:578、1 817、2 745、ll 575;E与F能形成原子数目 比为1:3、熔点为190℃的化合物Q.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com