
下列有关NA的说法正确的是
A.18g D2O和18g H2O中含有的质子数均为10NA
B.2L 0.5 mol·L-1亚硫酸溶液中含有的H+离子数为2NA
C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
D.标准状况下,2.24L Cl2与过量的稀FeI2溶液反应,转移电子总数为0.1NA
科目:高中化学 来源:2015-2016学年山东省高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列各组物质中分子数相同的是
A.2LCO和2LCO2
B.9gH2O和标准状况下11.2LCO2
C.标准状况下1molO2和22.4LH2O
D.0.2molH2和4.48LHCl气体
查看答案和解析>>
科目:高中化学 来源:2016届湖南省衡阳市高三上学期第三次月考化学试卷(解析版) 题型:选择题
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是
A.若X+和Y2-的核外电子层结构相同,则原子序数:X > Y
B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S
C.硅、锗都位于金属与非金属的交界处,都可以做半导体材料
D.Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2
查看答案和解析>>
科目:高中化学 来源:2016届安徽省安庆市高三上学期第一次质检化学试卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理解释的是
A.打开汽水瓶有气泡从溶液中冒出
B.实验室用排饱和食盐水法收集氯气
C.合成氨工厂采用增大压强以提高原料的转化率
D.2NO2(g)  N2O4(g)的平衡体系中,加压缩小体积后颜色加深
N2O4(g)的平衡体系中,加压缩小体积后颜色加深
查看答案和解析>>
科目:高中化学 来源:2016届吉林省扶余市高三上学期第一次月考化学试卷(解析版) 题型:推断题
(共15分)利用芳香烃X和烯烃Y可以合成紫外线吸收剂BAD,其结构简式为:

BAD的合成路线如下:
已知:G不能发生银镜反应,B遇FeCl3溶液显紫色,C到D的过程为引入羧基(—COOH)的反应。
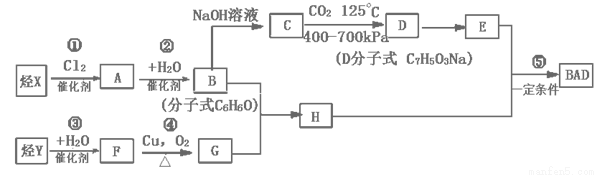
试回答下列问题:
(1)写出结构简式:Y ,D 。
(2)上述属于取代反应的有 ( 填数字序号)。
(3)1molBAD最多可与含 molNaOH的溶液完全反应。
(4)E有多种同分异构体,判断符合下列要求的同分异构体数目为 种。
①能发生银镜反应 ②遇FeCl3溶液显紫色 ③核磁共振氢谱图中有四个吸收峰
(5)写出反应④方程式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期第一次月考化学试卷(解析版) 题型:选择题
25℃,向纯水中加入少量的冰醋酸,有关该溶液的说法错误的是
A.酸性增强
B.c(H+)和c(OH-)的乘积增大
C.pH减小
D.c(OH-)减小
查看答案和解析>>
科目:高中化学 来源:2016届河北省邯郸市高三上学期10月月考化学试卷(解析版) 题型:选择题
下列依据热化学方程式得出的结论正确的是
A.已知:2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
B.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
D.已知2C(s)+2O2(g)===2CO2(g) ΔH1, 2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1<ΔH2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二上学期10月月考化学试卷(解析版) 题型:填空题
(8分)已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
醋酸 | 碳酸 | 亚硫酸 |
Ka= 1.75×10-5 | Ka1= 4.30×10-7 Ka2 = 5.61×10-11 | Ka1= 1.54×10-2 Ka2 = 1.02×10-7 |
(1)写出碳酸的第一步电离平衡常数表达式:Ka1 = 。
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱: > > 。
(3)下图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液PH随水量的变化

①图像中,曲线I表示的酸是 (填化学式)。
②A、B、C三点中,水的电离程度最大的是 (填字母)。
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期第一次检测化学试卷(解析版) 题型:实验题
(12分)实验室用固体烧碱配制500 mL 0.1 mol·L―1的NaOH溶液。
(1)需称量____________g的烧碱固体,它应该盛放在____________ 中进行称量。
(2)配制过程中,不需要使用的仪器是(填写代号)_________________。
A.烧杯 B.量筒 C.1000 mL容量瓶 D.托盘天平E.药匙 F.500 mL容量瓶 G.胶头滴管 H.漏斗
除上述可使用的仪器,还缺少的仪器是_________ ,
(4)叙述定容过程中的操作___________________________________。
(5)要配制浓度约为2 mol·L-1 NaOH溶液100 mL,下列操作正确的是_____ 。
①称取8 g NaOH固体,放入250 mL烧杯中,用100 mL量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解。
②称取8 g NaOH固体,放入100 mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL。
③称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加水至刻度线,塞好瓶塞,反复摇匀。
④用100 mL量筒量取40 mL 5 mol·L-1 NaOH,倒入250 mL烧杯中,再用同一量筒量取60 mL蒸馏水,不断搅拌下,慢慢倒入烧杯中。
(6)下列操作导致所配溶液浓度偏高的是
A.称量时,左盘高,右盘低 B.定容时俯视容量瓶刻度线
C.原容量瓶洗净后没有干燥 D.摇匀后见液面下降,再加水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com