
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。
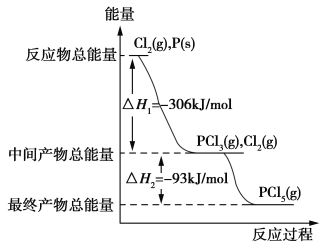
根据图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式为_____________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式为_____________________。
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=________,P和Cl2一步反应生成1 mol PCl5的ΔH4________(填“>”“<”或“=”)ΔH3。
【答案】P(s)+![]() Cl2(g)=PCl3(g) ΔH=-306 kJ/mol PCl5(g)=Cl2(g)+PCl3(g) ΔH=+93 kJ/mol -399kJ/mol =
Cl2(g)=PCl3(g) ΔH=-306 kJ/mol PCl5(g)=Cl2(g)+PCl3(g) ΔH=+93 kJ/mol -399kJ/mol =
【解析】
(1)根据图象,生成气态的PCl3,ΔH =-306 kJ/mol。P为固体,Cl2 为气体,则热化学方程式为P(s)+![]() Cl2(g)=PCl3(g) ΔH=-306 kJ/mol;
Cl2(g)=PCl3(g) ΔH=-306 kJ/mol;
答案为:P(s)+![]() Cl2(g)=PCl3(g) ΔH=-306 kJ/mol (2)从图象来看, PCl3(g)和Cl2 (g)生成PCl5 (g),ΔH =- 93 kJ/mol。现在要求PCl5 (g)分解成PCl3(g)和Cl2(g),ΔH应为+ 93 kJ/mol。则热化学方程式为PCl5(g)=Cl2(g)+PCl3(g) ΔH=+93 kJ/mol ;
Cl2(g)=PCl3(g) ΔH=-306 kJ/mol (2)从图象来看, PCl3(g)和Cl2 (g)生成PCl5 (g),ΔH =- 93 kJ/mol。现在要求PCl5 (g)分解成PCl3(g)和Cl2(g),ΔH应为+ 93 kJ/mol。则热化学方程式为PCl5(g)=Cl2(g)+PCl3(g) ΔH=+93 kJ/mol ;
答案为:PCl5(g)=Cl2(g)+PCl3(g) ΔH=+93 kJ/mol (3)从图象来看,ΔH3=ΔH1+ΔH2=- 306 kJ/mol+ ( -93 kJ/mol)= -399 kJ/mol。化学反应热△H只和反应物、生成物的能量有关,与反应路径无关,只要反应物和生成物一样,不管是经过一步还是二步反应,反应热相同,因此ΔH4等于ΔH3。
答案为:-399 kJ/mol ;=


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,在10mL0.1mol/LNa2CO3溶液中逐滴加入0..1mol/LHCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法不正确的是
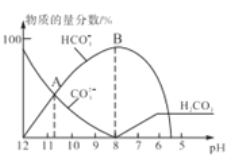
A. 常温下,水解常数Kh(CO32-)的数量级为10-4
B. 当溶液是中性时,溶液的总体积大于20mL
C. 在0.1mol/LNa2CO3溶液中:c(OH-)>c(H2CO3)+c(HCO3-)+c(H+)
D. 在B点所示的溶液中,离子浓度最大的是HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程如下,下列说法中,错误的是( )
![]()
A. 操作①发生的反应为非氧化还原反应
B. 若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器
C. 操作②是蒸发浓缩结晶
D. 在整个制备过程中,未发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列叙述正确的是
A.0.1mol Fe与100mL 1mol·L-1盐酸充分反应,溶液中的Fe2+数目为0.1NA
B.0.1mol·L-1(NH4)2SO4溶液中含SO42-数目为0.1NA
C.常温常压下,1.8g H2O中含有的分子数为0.1NA
D.33.6LNO2和足量水反应转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,某绝热恒容密闭容器中的反应2N2O5(g) ![]() 4NO2(g)+O2(g) ΔH>0达到平衡状态,下列有关该状态时的说法中正确的是
4NO2(g)+O2(g) ΔH>0达到平衡状态,下列有关该状态时的说法中正确的是
A. N2O5,NO2,O2分子个数比为 2∶4∶1B. 混合气体的密度不再改变
C. 体系温度不再改变D. N2O5已全部转化为NO2和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙、丙分别表示在不同条件下,可逆反应A(g)+B(g)![]() xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。
xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。
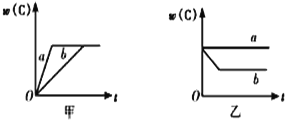
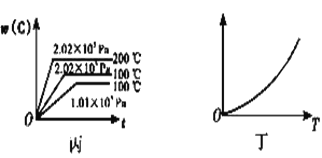
(1)若甲中两条曲线分别代表有催化剂和无催化剂的情况,则_____曲线代表无催化剂时的情况。
(2)若乙表示反应达到平衡状态后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He后的情况,则____曲线表示恒温恒容的情况,且此时混合气体中w(C)____(填“变大”“变小”或“不变”)。
(3)根据丙可以判断该可逆反应的正反应是____(填“放热”或“吸热”)反应,x的值为____。
(4)丁表示在某固定容积的密闭容器中,上述可逆反应达到平衡后,某物理量随温度(T)的变化情况,根据你的理解,丁的纵坐标可以是_____ (填序号)。
①w(C) ②A的转化率 ③压强 ④c(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和铝粉的混合物逐渐加入100mL的稀硝酸中,其产生的有关离子浓度与加入铁粉和铝粉的混合物的质量的关系如下图所示:
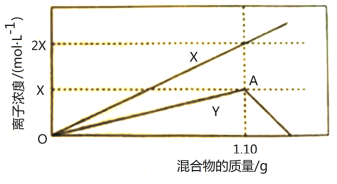
若反应过程中生成的气体为NO,溶液的体积变化忽略不计。请回答下列问题:
(1)X表示的变化离子是_______________(填离子符号)。
(2)OA段发生反应的离子方程式是___________________________________。
(3)稀硝酸溶解1.10g铁粉和铝粉后溶液还能继续溶解混合物的原因是________________
(4)该硝酸的浓度是_____________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对SO2使溶液褪色的机理进行探究。
I.SO2气体的制备和性质初探
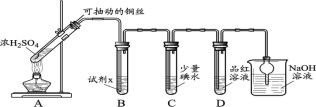
(1)装置A中发生反应的化学方程式____________。
(2)装置B中的试剂x是____________。
(3)小组同学观察到C、D中溶液均褪色,通过检验C溶液中有SO42-,得出C中溶液褪色的原因是____________。
II.小组同学通过实验继续对D中品红溶液褪色进行探究。
(4)探究使品红褪色的主要主要微粒(分别取2 mL试剂a,滴加2滴品红溶液)
装置 | 序号 | 试剂a | 实验现象 |
| i | 0.1 mol/L SO2溶液(pH=2) | 红色逐渐变浅,之后完全褪色 |
ii | 0.1 mol/L NaHSO3溶液(pH=5 ) | 红色立即变浅,之后完全褪色 | |
iii | 0.1 mol/L Na2SO3溶液( pH=10) | 红色立即褪色 | |
iv | pH=2H2SO4溶液 | 红色无明显变化 | |
v | 试剂a | 红色无明显变化 |
①实验 iii中Na2SO3溶液显碱性的原因_____________(结合化学用语分析解释)。
②对比实验iii 和v,可以排除在该实验条件下OH-对品红褪色的影响,则试剂a可能
是__________溶液。
查阅资料:品红与SO2水溶液、NaHSO3溶液、Na2SO3溶液反应前后物质如下:
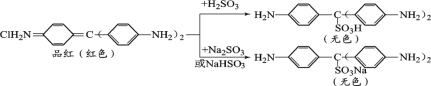
③通过上述实验探究并结合资料,小组同学得出结论:一是使品红溶液褪色的主要微粒是________;二是品红溶液中颜色变化主要与其分子中的________结构有关。
(5)验证SO2使品红褪色反应的可逆性
①甲同学加热实验i褪色后的溶液,产生刺激性气味气体,红色恢复,从化学平衡移动角度解释红色恢复的原因__________。
②乙同学向实验i褪色后的溶液中滴入Ba(OH)2溶液至pH=10,生成白色沉淀,溶液变红。写出生成白色沉淀的离子方程式___________。
③丙同学利用SO2的还原性,运用本题所用试剂,设计了如下实验,证实了SO2使品红褪色反应的可逆:则试剂Y是__________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com