

| 1.12L |
| 22.4L/mol |
| 7.4g |
| 0.1mol |
 ��CΪ��CH3��3CONa��DΪCH2=C��CH3��2��DΪCH2BrCBr��CH3��2��Ȼ�����л���Ľṹ�����������
��CΪ��CH3��3CONa��DΪCH2=C��CH3��2��DΪCH2BrCBr��CH3��2��Ȼ�����л���Ľṹ�����������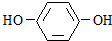 ��
�� ��AΪ��CH3��3COH��GΪ
��AΪ��CH3��3COH��GΪ ��A��G��һ��������������γ�ˮ��һ��ʳƷ��������H��H������������Һ���õõ���ѧʽΪC10H12O2Na2�Ļ������H�������ԣ�A��G����ȡ����Ӧ����H������HΪ
��A��G��һ��������������γ�ˮ��һ��ʳƷ��������H��H������������Һ���õõ���ѧʽΪC10H12O2Na2�Ļ������H�������ԣ�A��G����ȡ����Ӧ����H������HΪ ��
�� ��
�� ��
�� ��
��


 �»����ܶ�Ա��ϵ�д�
�»����ܶ�Ա��ϵ�д� ����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2.24L | B��2.8L |
| C��3.36L | D��4.48L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����������Է���Ӧ |
| B�����������Է���Ӧ |
| C���������Ƿ��Է���Ӧ�����������Է���Ӧ |
| D���κ��¶��¶��Ƿ��Է���Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��NaHSO4 |
| B��NaCl |
| C��Na2CO3 |
| D��NH3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �����£���0.2mol/LAl2��SO4��3����Һ�У���μ���1.0mol/LNaOH��Һ��ʵ������ҺpH��NaOH��Һ����仯������ͼ�������й�˵����ȷ���ǣ�������
�����£���0.2mol/LAl2��SO4��3����Һ�У���μ���1.0mol/LNaOH��Һ��ʵ������ҺpH��NaOH��Һ����仯������ͼ�������й�˵����ȷ���ǣ�������| A��a��ʱ����Һ�����Ե�ԭ����Al3+ˮ�⣬���ӷ���ʽΪ��Al3++3OH-?Al��OH��3 |
| B��d��ʱ��Al��OH��3������ʼ�ܽ� |
| C��a-b�Σ���ҺpH����A13+Ũ�Ȳ��� |
| D��b-c�Σ������OH-��Ҫ��������Al��OH��3���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��NaHCO3��Al��OH��3 |
| B��BaCl2��NaCl |
| C��KClO3��K2SO4 |
| D��Na2SO3��BaCO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��+7.28 kJ?mol-1 |
| B��-7.28 kJ?mol-1 |
| C��+43.68 kJ?mol-1 |
| D��-43.68 kJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��
| ||
B��
| ||
C��
| ||
D��
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��5 mol�� |
| B�����������ӵ�Ħ������Ϊ17g |
| C��0.1 mol H2O����Լ��6.02��1022������ |
| D�������Ħ����������ֵ�ϵ����������ԭ������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com