
硫铁矿烧渣是一种重要的化工生产中间产物,主要成分是Fe3O4、Fe2O3、FeO和二氧化硅等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁的流程图:
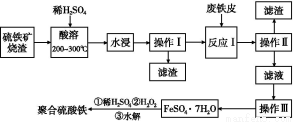
(1)实验室实现“操作Ⅰ”所用的玻璃仪器有 、玻璃棒和烧杯。“操作Ⅲ”系列操作名称依次为 、 、过滤和洗涤。
(2)“酸溶”过程中Fe3O4溶解的化学反应方程式为 。
(3)硫铁矿烧渣在“酸溶”前要粉碎的主要目的是 。
(4)实验室检验“反应Ⅰ”已经完全的试剂是 ,现象是 。
(5)加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式: 。
(1)漏斗 蒸发浓缩 冷却结晶
(2)Fe3O4+4H2SO4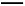 FeSO4+Fe2(SO4)3+4H2O
FeSO4+Fe2(SO4)3+4H2O
(3)增大烧渣与硫酸的接触面积,加快烧渣的溶解
(4)KSCN溶液 溶液不呈红色
(5)2Fe2++H2O2+2H+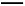 2Fe3++2H2O
2Fe3++2H2O
【解析】(1)根据流程图可知,操作Ⅰ为过滤,需要的玻璃仪器有漏斗、玻璃棒、烧杯。操作Ⅲ的目的是由溶液得到晶体FeSO4·7H2O,故需蒸发浓缩、冷却结晶。
(2)Fe3O4和H2SO4发生复分解反应生成FeSO4、Fe2(SO4)3。
(3)将固体粉碎能增大接触面积,加快反应。
(4)反应Ⅰ为:Fe+2Fe3+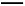 3Fe2+,取清液,用KSCN溶液检验不显红色,从而确认Fe3+反应完全。
3Fe2+,取清液,用KSCN溶液检验不显红色,从而确认Fe3+反应完全。
(5)H2O2作氧化剂时其还原产物为H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014高考化学名师知识点精编 专题1物质的分类分散系练习卷(解析版) 题型:选择题
通过复习总结,下列归纳正确的是( )
A.Na2O、NaOH、Na2CO3、NaCl、Na2SO4、Na2O2都属于钠的含氧化合物
B.简单非金属阴离子只有还原性,而金属阳离子不一定只有氧化性
C.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
D.物质发生化学变化一定有化学键断裂与生成,并伴有能量变化,而发生物理变化就一定没有化学键断裂与生成,也没有能量变化
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题16硫及其化合物练习卷(解析版) 题型:选择题
下列相关化学与生活、生产的叙述错误的是( )
A.用作“钡餐”的物质主要成分是硫酸钡
B.采用催化设施,将汽车尾气中CO和NO转化为无害气体
C.常温下,可以用铁制容器来盛装冷的浓硫酸
D.SO2具有氧化性,可用于漂白纸浆
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题15富集在海水的元素-氯溴碘练习卷(解析版) 题型:选择题
下列反应中氯元素被氧化的是( )
A.MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
B.2HCl+Ca(OH)2 CaCl2+2H2O
CaCl2+2H2O
C.5Cl2+I2+6H2O 10HCl+2HIO3
10HCl+2HIO3
D.2KClO3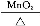 2KCl+3O2↑
2KCl+3O2↑
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题14无机非金属材料-碳和硅练习卷(解析版) 题型:选择题
取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,下列有关说法正确的是( )
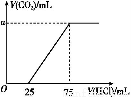
A.原溶液中NaOH的物质的量为0.75 mol
B.通入CO2后所得的溶液溶质成分为NaOH和Na2CO3
C.通入CO2后所得的溶液中含有2.5×10-3 mol NaHCO3
D.纵坐标中a的数值为224
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题13铁、铜及其重要化合物练习卷(解析版) 题型:选择题
向100 mL 18 mol/L的硫酸中加入足量铜片,加热并充分反应。下列有关说法正确的是( )
A.充分反应后转移1.8 mol电子
B.H2SO4只作氧化剂
C.若不加热应生成H2
D.消耗的铜的质量一定少于57.6 g
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题12钠、铝及其重要化合物练习卷(解析版) 题型:选择题
潜艇上的核反应堆使用液态铝钠合金(单质钠和单质铝熔合而成)作载热介质,下列有关说法正确的是( )
A.该合金的熔点介于钠、铝之间
B.钠或铝形成的氧化物均为碱性氧化物
C.钠和铝分别与不足量的盐酸反应所得溶液均呈中性
D.若合金中n(Na)>n(Al),将其投入到适量的水中可得无色透明溶液
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题11电化学练习卷(解析版) 题型:选择题
关于下列各装置图的叙述中,不正确的是( )
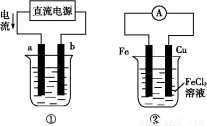
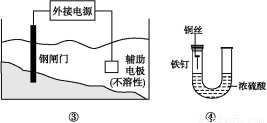
A.用装置①精炼铜,则a极为精铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Fe+2Fe3+=3Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷B(解析版) 题型:选择题
关于10 mL 0.1 mol·L-1的NH3·H2O溶液,下列说法正确的是( )
A.25 ℃时,若溶液的pH=11,则Kb(NH3·H2O)=1×10-6 mol·L-1
B.向溶液中加入少量CH3COONa固体,溶液中的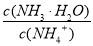 值变小
值变小
C.向溶液中加入10 mL 0.1 mol·L-1 HCl,所得溶液中离子浓度大小顺序为c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.向溶液中加入5 mL 0.1 mol·L-1 HCl,所得溶液中离子的浓度一定符合:c(NH4+)+c(H+)=c(Cl-)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com