
(15分)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
①2H2(g)+CO(g)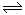 CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g)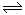 H2O(g)+CO(g) H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g)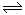 CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) | K3 | | |
(15分)(1)吸热(2分)
(2)=(2分) K1·K2(2分)
(3)加入催化剂(2分);将容器的体积(快速)压缩至2L(2分)
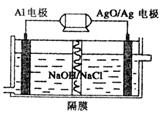
(4)Al-3e- + 4OH- = AlO2- + 2H2O(2分)
(5) ×10-7 (3分)
×10-7 (3分)
解析试题分析:(1)温度升高,反应②的化学平衡常数增大,说明升温对正反应有利,所以正反应是吸热反应;
(2)A与B的平衡状态不同,但温度相同,所以化学平衡常数相同,K(A)=K(B);根据盖斯定律,③=①+②,所以K3=K1·K2;
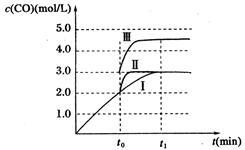
(3)曲线Ⅱ与曲线I相比,CO的浓度未变,说明平衡未移动,但达平衡的时间缩短,说明反应速率加快,所以改变的条件是使用了催化剂;曲线III与曲线I相比,t0时刻CO的浓度瞬间增大到3mol/L,所以只能是缩小容器的体积,压强增大,因为反应②是反应前后气体物质的量不变的反应,所以平衡不移动,曲线I与曲线III中的CO的物质的量相等,原平衡中CO的物质的量是3mol/L×3L=9mol,所以新平衡时容器的体积是9mol/4.5mol/L=2L,所以改变的条件是将容器的体积(快速)压缩至2L;
(4)Al比Ag活泼,所以Al做负极,失去电子生成的铝离子与氢氧根离子反应最终生成偏铝酸根离子和水,电极反应式为Al-3e- + 4OH- = AlO2- + 2H2O
(5)反应平衡时,2c(Ba2+)=c(CH3COO-),根据电荷守恒规律,有反应平衡时,2c(Ba2+)+c(H+)=c(CH3COO-)+c(OH-),所以溶液为中性,c(H+)= c(OH-)=1×10-7mol/L,醋酸是弱酸,氢氧化钡是强碱,所以醋酸钡的溶液应呈碱性,现在溶液为中性,说明醋酸过量,设醋酸、氢氧化钡的体积均是1L,完全反应后c(Ba2+)=b/2mol/L,所以溶液中剩余醋酸的浓度为(a-2b)mol/2L,c(CH3COO-)="2" c(Ba2+)=2×b/2mol/L=bmol/L,该混合溶液中醋酸的电离常数为K= c(CH3COO-)·c(H+)/ c(CH3COOH)= ×10-7
×10-7
考点:考查化学反应热效应的判断,盖斯定律的应用,对图像的分析,电化学原理的应用,化学平衡常数的计算


科目:高中化学 来源: 题型:填空题
(2分)某温度时,在2L固定体积的密闭容器中X、Y、Z三种气体随时间的变化如图所示: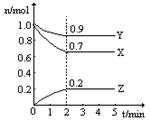
(1)该反应的化学方程式为 ;
(2)下列表示该反应速率最大的是
A.v(X)=0.6mol/(L·s) B.v(Y)=0.3mol/(L·s) C.v(Z)=0.5mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢能被视为未来的理想清洁能源,科学家预测“氢能”将是21世纪最理想的新能源。目前分解水制氢气的工业制法之一是“硫—碘循环”,主要涉及下列反应:
Ⅰ SO2+2H2O+I2= H2SO4+2HI Ⅱ 2HI H2+I2
H2+I2
Ⅲ 2H2SO4= 2SO2↑+O2↑+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行 b.反应I中SO2还原性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2的同时产生1molH2
(2)一定温度下,向2L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。0—2min内的平均反应速率v(HI)= 。该温度下,反应2HI(g) H2(g)+I2(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
H2(g)+I2(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)SO2在一定条件下可被氧化生成SO3,其反应为:2SO2 (g) + O2(g)  2SO3(g) △H<0。某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
2SO3(g) △H<0。某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。 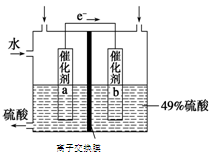
①a电极的电极反应式为 ;
②若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为 。
(4)实际生产还可以用氨水吸收SO2生成亚硫酸的铵盐。现取a克该铵盐,若将其中的SO2全部反应出来,应加入10 mol/L的硫酸溶液的体积范围为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)(1)某温度时,在2 L密闭容器中,X、Y、Z三种物质的物质的量随时间变化曲线如下图所示。由图中数据分析,该反应的化学方程式为:____________________________
(2) 用Z表示从0—2min内该反应的平均反应速率为
____________________
(3) 某时刻t(t﹤5min)测得Y、Z两者的物质的量之比为
3:1,则X的转化率为_________
(4) 该条件下,能说明反应已达到平衡状态的是
a.容器内z物质的量浓度为0.25mol/L
b.正反应和逆反应的速率都为0
c.容器内X、Y、Z物质的量之比为1∶3∶2
d.容器内X气体的体积分数不变
e. 单位时间内消耗3a mol X,同时生成2a mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH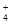 | SO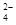 | NO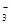 | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
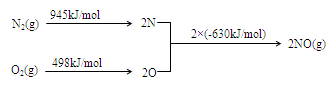
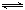 2NO(g)△H= 。
2NO(g)△H= 。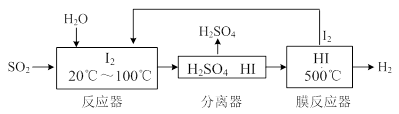
 NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g) Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分) 某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置。
(1)检查图1所示装置气密性的方法是____________________。
(2)若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量__________________________。
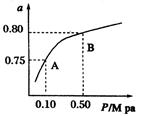
(3)实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间段内反应速率逐渐加快的主要原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在2 L密闭容器内,800℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com