
【题目】某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
② | 醋酸浓度的影响 | 0.5 | __ | 36.0 |
③ | __ | 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了_____________腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了__(“氧化”或“还原”)反应,其电极反应式是___________________________________。
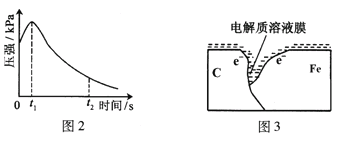
(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:______________________________;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
实验步骤和结论(不要求写具体操作过程):__________
【答案】2.0 碳粉含量的影响 吸氧 还原反应 2H2O+O2+4e-=4OH- (或4H++O2+4e-=2H2O) 反应放热,温度升高,体积膨胀 实验步骤和结论(不要求写具体操作过程)
①药品用量和操作同编号①实验(多孔橡皮塞增加进、出导管)
②通入氩气排净瓶内空气;
③滴入醋酸溶液,同时测量瓶内压强变化(也可测温度变化,检验Fe2+等)。
如果瓶内压强增大,假设一成立。否则假设一不成立。
(本题属于开放性试题,合理答案均给分)
【解析】
(1)探究影响化学反应速率,每次只能改变一个变量,故有②中铁的量不变,为2.0g;
③中改变了碳粉的质量,故为探究碳粉的量对速率的影响。
(2) t2时,容器中压强明显小于起始压强,说明锥形瓶中气体体积减小,说明发生了吸氧腐蚀,碳为正极,铁为负极,碳电极氧气得到电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,故答案为:还原;O2+2H2O+4e-=4OH-;
(3) 图2中0-t1时压强变大的原因可能为:铁发生了析氢腐蚀、铁与醋酸的反应为放热反应,温度升高时锥形瓶中压强增大,所以假设二为:反应放热使锥形瓶内温度升高,故答案为:反应放热使锥形瓶内温度升高;
(4)基于假设一,可知,产生氢气,发送那些变化,从变化入手考虑
实验步骤和结论(不要求写具体操作过程)
①药品用量和操作同编号①实验(多孔橡皮塞增加进、出导管)
②通入氩气排净瓶内空气;
③滴入醋酸溶液,同时测量瓶内压强变化(也可测温度变化,检验Fe2+等)。
如果瓶内压强增大,假设一成立。否则假设一不成立。
(本题属于开放性试题,合理答案均给分)。


科目:高中化学 来源: 题型:
【题目】为了配制NH4+浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入:①适量HCl②适量NaCl③适量的氨水④适量的NaOH,正确的是
A. ①② B. ④ C. ③④ D. ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+
B.向ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀
C.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
D.溶解度小的沉淀不能转化为溶解度大的沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:
H2O2+I-=H2O+IO-;H2O2+IO-=H2O+O2↑+I-。总反应的化学方程式是________________。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是___________(填字母)。
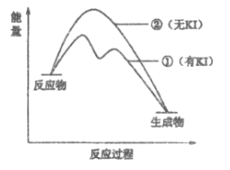
a. 加入KI后改变了反应的路径
b. 加入KI后改变了总反应的能量变化
c. H2O2+I-=H2O+IO-是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
①加CCl4并振荡、静置后还可观察到___________,说明有I2生成。
②气泡明显减少的原因可能是:i. H2O2浓度降低;ii. ________。以下对照实验说明i不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是_____________。
(4)资料4:I-(aq)+I2(aq)![]() I3-(aq) K=640。
I3-(aq) K=640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10mL 0.10mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
微粒 | I- | I2 | I3- |
浓度/(mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
①a=__________。
②该平衡体系中除了含有I-,I2,I3-外,一定还含有其他含碘微粒,理由是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )
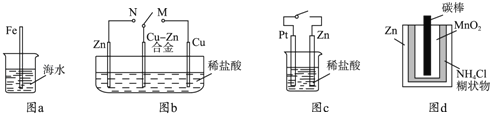
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.天然弱碱水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子
B.生活中用电解食盐水的方法制取消毒液,运用了盐类水解的原理
C.向CuCl2溶液中加入CaCO3,调节pH可除去溶液中混有的Fe3+
D.焊接时用NH4Cl溶液除锈与盐类水解有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙烯醇肉桂酸酯(M)可用作光刻工艺中的抗腐蚀涂层,其合成路线如下:

已知:R1—CHO+R2—CH2CHO![]() CHOHR1CHCHOR2
CHOHR1CHCHOR2
请回答:
(1)C的化学名称为______________;M中含氧官能团的名称为____________。
(2)F→G的反应类型为__________;
检验产物G中新生成官能团的实验方法为______________________________。
(3)C→D的化学方程式为________________________________________。
(4)E的结构简式为_______________________;
H的顺式结构简式为_____________________________。
(5)同时满足下列条件的F的同分异构体有________种(不考虑立体异构);
①属于芳香族化合物 ②能发生水解反应和银镜反应
其中核磁共振氢谱有4种吸收峰的物质的结构简式为_________________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.05 mol Na2CO3固体溶于水配成100 mL溶液,向溶液中加入下列物质,有关结论正确的是( )
加入物质 | 结论 | |
A | 50 mL 1 mol·L-1H2SO4 | 反应结束后,c(Na+)=c(SO |
B | 0.05 mol CaO | 溶液中 |
C | 50 mL H2O | 由水电离出的c(H+)·c(OH-)不变 |
D | 0.1 mol NaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅精矿可用于冶炼金属铅,其主要成分为PbS。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
(1)用铅精矿火法炼铅的反应的化学方程式为_________。
(2)火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为:____。
II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:

已知:① 不同温度下PbCl2的溶解度如下表所示。
温度/℃ | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
② PbCl2为能溶于水的弱电解质,在Cl—浓度较大的溶液中,存在平衡: PbCl2(aq)+2Cl—(aq) ![]() PbCl42—(aq)
PbCl42—(aq)
(3)浸取液中FeCl3的作用是_________。
(4)结合信息判断,操作a为_________,以利于PbCl2的析出。
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。
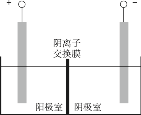
① 溶液3应置于______(填“阴极室”或“阳极室”)中。
② 简述滤液2电解后再生为FeCl3的可能原理:______。
③ 若铅精矿的质量为a g,铅浸出率为b,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数的计算式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com