
【题目】下面是A~G七种元素的电子排布:
元素 电子排布 电子层 | A | B | C | D | E | F | G |
K | 1 | 2 | 2 | 2 | 2 | 2 | 2 |
L | 4 | 5 | 6 | 8 | 8 | 8 | |
M | 1 | 3 | 7 |
试根据由上述元素构成的物质的化学式回答下列问题。
(1)写出一种常见的由非极性键形成的双原子分子:____________________。
(2)写出一种由极性键形成的双原子分子:____________________。
(3)写出一种由极性键形成的三原子分子:____________________。
(4)写出一种由三种元素形成的既含离子键又含共价键的化合物:__________,其电子式为____________________。
(5)写出一种既含离子键又含非极性键的化合物:__________,其电子式为__________。
科目:高中化学 来源: 题型:
【题目】美国康乃尔大学的威考克斯(C·Wilcox)所合成的一种有机分子就像一尊释迦牟尼佛像,因而称为释迦牟尼分子(分子中所有原子均在同一平面)如图。对于该有机物的叙述正确的是
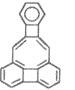
①该有机物属于芳香烃;②该有机物的分子式为C22H12; ③该有机物能发生加成反应;④该有机物的一氯代物的同分异构体有6种
A. ①③④B. ①②C. ②③D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产Al(OH)3并获得Fe3O4的部分工艺流程如图:

(1)焙烧过程均会产生SO2,用于吸收SO2的试剂可以是______。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如图所示。

已知:多数金属硫酸盐的分解温度都高于600℃
硫去除率=(1![]() )×100%
)×100%
①500℃焙烧(不添加CaO的矿粉)时,去除的硫元素主要来源于______。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低的主要原因是______。
(3)向含大量AlO2-的滤液中通入过量CO2,得到Al(OH)3白色沉淀,发生该反应的离子方程式为______。
(4)FeS2与滤渣中Fe2O3在缺氧条件下焙烧生成Fe3O4和SO2,理论上1molFeS2完全参与反应生成的Fe3O4的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料。
(1)写出实验室制取氨气的化学方程式_____。
(2)工业上合成氨的反应N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
过程中能量变化如图所示。
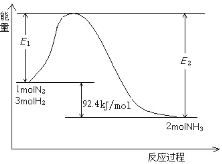
①该反应是_____反应。(填“放热”或“吸热”)
②在反应体系中加入催化剂,E2会_____。(填“增大”或“减小”或“不变”)
③若要增大NH3产率,可采取的措施有_____。(填字母)
a.升高温度 b.增大压强 c.不断分离出NH3
(3)利用如图所示装置探究NH3能否被NO2氧化。
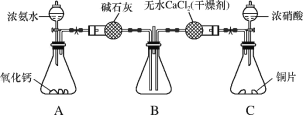
①C装置中制取NO2反应的离子方程式是_____。
②某同学认为NH3能被NO2氧化,且全部生成无毒物质,预期观察到B装置中红棕色消失。下表为不同时间下观察到的现象。
时间 | 1分钟 | 2分钟 | 3分钟 |
现象 | 红棕色未消失 | 红棕色未消失 | 红棕色未消失 |
请分析没有达到预期现象可能的原因(任写两条)_____、_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的有
①3lg白磷中含有1.5NA个P-P键
②1L0.1mol·L-1的Na2CO3溶液中所含阴离子的总数目为0.1NA
③标准状况下,22.4LHF 中含有NA个分子
④电解精炼铜时,若转移NA个电子,则阳极溶解32g铜
⑤将2.24L(标准状况)Cl2溶于水,转移的电子数为0.1NA
⑥常温下,含有0.2molH2SO4的浓硫酸与足量铜反应,生成SO2分子的数目小于0.1NA
⑦142gNa2SO4 和Na2HPO4的固体混合物中所含阴、阳离子的总数目为3NA
⑧NA个Fe(OH)3胶体粒子的质量为107g
A.2项B.3项C.4项D.5项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学·选修3:物质结构与性质
氟及其化合物用途非常广泛,自然界中氟多以化合态形式存在,主要有萤石(CaF2)、冰晶石( Na3AlF6)等。回答下列问题:
(1)基态氟原子中有_________________种能量不同的电子。
(2)NF3是微电子工业中优良的等离子刻蚀气体。NF3与NH3的空间构型相同,但是NH3( -33° C)的沸点比NF3( -129° C)的高,原因为_____________。
(3)氟硼酸( HBF4,属于强酸)常用于替代浓硫酸作铅蓄电池的电解质溶液,可由HF和BF3合成,从化学键形成角度分析HF与BF3能化合的原因:________。
(4)液态[H2F]+中存在[H2F]+和[HF2]- ,[HF2]-的结构可表示为[F-H…F]- ,[H2F]+的VSEPR模型名称为________形。NaHF2可用于制无水氟化氢和供雕刻玻璃、木材防腐等。常温常压下为白色固体,易溶于水,160°C分解。NaHF2中所含作用力的类型有______. (填字母)。
a 离子键 b 共价键 c 配位键 d 氢键
(5)CaF2是难溶化合物,其品胞结构如图所示:
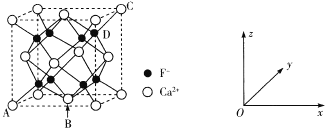
①若原子坐标参数A处为(0,0,0),B处为(![]() ,C处为(1,1,1),则D处为_____.
,C处为(1,1,1),则D处为_____.
②每个Ca2+周围距离最近的Ca2+共有_____个。
③已知:CaF2晶体密度为cg·cm-3 ,则晶胞中Ca2+与最近的F-之间的距离为____nm(设NA表示阿伏加德罗常数的值,用含c、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家利用电解NaB(OH)4溶液制备H3BO3的工作原理如下图。 下列说法中正确的是
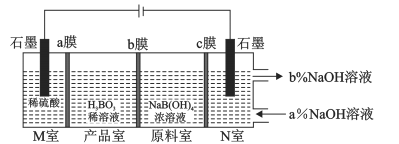
A.b膜为阳离子交换膜
B.N室中,进口和出口NaOH溶液的浓度:a%<b%
C.电子从左边石墨电极流出,先后经过a、b、c膜流向右边石墨电极
D.理论上每生成1molH3BO3,两极室共生成33.6L气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的核磁共振氢谱如图M1-1所示,下列说法中,错误的是
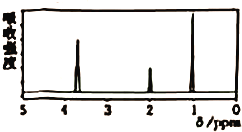
A. 若A的分子式为![]() ,则其结构简式为
,则其结构简式为![]()
B. 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子,且个数之比为1:2:3
C. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D. 若A的化学式为![]() ,则其同分异构体有3种
,则其同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)图甲为晶体的二维平面示意图,所表示物质的化学式可能为AX2的是______(填“a”或“b”)。
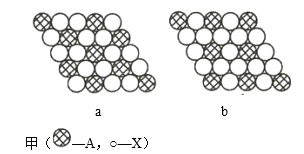
(2)图乙为金属铜的晶胞示意图,请回答下列问题。
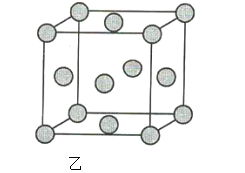
①该晶胞实际含有的铜原子数是______。
②该晶胞称为______(填序号)。
A.六方晶胞 B.体心立方晶胞 C.面心立方晶胞 D.简单立方晶胞
③该晶胞的边长为a cm, Cu的摩尔质量为64g·mol-1,金属铜的密度为pg·cm-3,则阿伏加德罗常数为___(用含a、p的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com