
【题目】某温度下,在容积为1L的密闭容器中充入![]() 和
和![]() 发生
发生![]() 测得
测得![]() 的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数
的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数![]() )下列说法正确的是 ( )
)下列说法正确的是 ( )
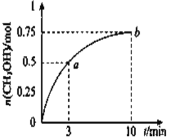
A. ![]()
B. 点b所对应的状态为化学平衡状态
C. ![]() 的生成速率,点a低于点b
的生成速率,点a低于点b
D. 欲增大平衡状态时![]() ,可保持其他条件不变,升高温度
,可保持其他条件不变,升高温度
【答案】B
【解析】
据定义计算反应速率,并利用不同物质表示的反应速率之间的关系进行换算;据可逆反应进行过程中正逆反应速率的变化,比较有关速率的大小;利用Qc与K的关系判断是否化学平衡状态;用平衡移动原理判断平衡移动方向。
A项:0~10min,n(CH3OH)增加0.75mol,v(CH3OH)=0.75mol/(1L×10min)=0.075mol·L-1·min-1,则v(H2)=0.075mol/(1L×10min)×3=0.225mol·L-1·min-1,A项错误;
B项:据图中数据,点b所在状态有0.25molCO2、1.0molH2、0.75molCH3OH、0.75molH2O(g),将它们的浓度代入Qc表达式,得Qc=2.25=K,为化学平衡状态,B项正确;
C项:从起始到平衡过程中,![]() 的生成速率(正反应速率)逐渐减小,即正反应速率点a高于点b,C项错误;
的生成速率(正反应速率)逐渐减小,即正反应速率点a高于点b,C项错误;
D项:欲使平衡状态时![]() 增大,即使平衡右移。因ΔH<0,可保持其他条件不变降低温度,D项错误。
增大,即使平衡右移。因ΔH<0,可保持其他条件不变降低温度,D项错误。
本题选B。


科目:高中化学 来源: 题型:
【题目】燃煤的烟气中含有 SO2,为了治理雾霾天气,工厂采用多种方法实现烟气脱硫。
Ⅰ.(1)“湿式吸收法”利用吸收剂与 SO2 发生反应从而脱硫。下列试剂中适合用作该法吸收剂的是_____(填字母序号)。
a. 石灰乳 b.CaCl2溶液
(2)某工厂利用含 SO2 的烟气处理含Cr2O72-的酸性废水,吸收塔中反应后的铬元素以Cr3+形式存在,具体流程如下:

①用 SO2 处理含铬废水时,利用了 SO2 的_____性。
②吸收塔中发生反应的离子方程式为_____。
Ⅱ.石灰-石膏法和烧碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为Ca(OH)2+SO2= CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O =2CaSO4·2H2O。其流程如图:

烧碱法的吸收反应为2NaOH+SO2=Na2SO3+H2O。该法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如图:

已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收 SO2 的成本(元/mol) | 0.027 | 0.232 |
(3)石灰-石膏法和烧碱法相比,石灰-石膏法的优点是_______,缺点是_______。
(4)某学习小组在石灰-石膏法和烧碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案,流程图中的甲、乙、丙各是_____、_____、_____(填化学式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 合成氨工业选择的反应条件不是室温,是500℃左右
B. 配制氯化铁溶液时,将氯化铁加入盐酸中,然后加水稀释
C. 实验室常用排饱和食盐水的方法收集氯气
D. 硫酸工业中,使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)。
2Fe(s)+3CO2(g)。
(1)①该反应的平衡常数表达式为:K=___。
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为___。
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:①___②___。
(3)明矾KAl(SO4)2·12H2O的水溶液呈___性(填”酸性、碱性、中性),溶液中各离子的浓度从大到小的顺序为____。
(4)写出氢氧化铝在水中发生酸式电离的电离方程式:___,欲使上述体系中Al3+浓度增加,可加入的物质是____。
(5)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是____。
a. b.
b. c.
c. d.
d.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用下列装置测定SO2催化氧化为SO3的转化率(部分夹持装置已省略,已知SO3的熔点为16.8℃,假设气体进入装置时均被完全吸收,且忽略空气中CO2的影响),下列说法不正确的是( )
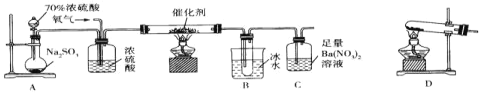
A.A装置烧瓶中发生的反应可以表示为SO32-+2H+=SO2↑+H2O
B.用D装置制备氧气,试管中的药品可以是KClO3
C.当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气
D.C中产生的白色沉淀是BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列结构示意图,判断下列说法中正确的是

A. 在NaCl晶体中,距Na+最近的多个Cl-构成正四面体
B. 在CaF2晶体中,Ca2+的配位数为4
C. 在金刚石晶体中,碳原子与碳碳键数之比为1:2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由下列方法制得高效饮用水处理剂高铁酸钠(Na2FeO4):Fe2O3+3Na2O2![]() 2Na2FeO4+Na2O,下列说法正确的是
2Na2FeO4+Na2O,下列说法正确的是
A.Fe粉与Al2O3可以通过铝热反应制Fe2O3
B.反应中Fe2O3是还原剂
C.3molNa2O2反应,有3mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子。向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图像如图所示。

(1)A、B、C、D四点中沉淀成分相同的是(写代号)_______________
(2)由图像可推出原溶液中一定含有的离子有:____________________
(3)若要检验可能存在的离子应采取的方法是______________________
(4)原溶液中含有的Fe3+和Al3+的物质的量之比为______________
(5)由图像计算使用的NaOH溶液的物质的量浓度是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在催化剂存在下,![]() 可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式_______,该反应中氧化产物与还原产物的物质的量之比是______。
可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式_______,该反应中氧化产物与还原产物的物质的量之比是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com