
| A. | CH3CH(NO2)COOH分子中含有“手性碳原子” | |
| B. | HS-和HC1均是含一个极性键的18电子粒子 | |
| C. | 当用带有静电的玻璃棒接近CH2Cl2和CC14液体细流时,细流都不发生偏转 | |
| D. | 1mol己烷含有的共价键数目为19NA(NA代表阿伏加德罗常数) |
分析 A、根据手性碳原子指连有四个不同基团的碳原子,手性碳原子判断注意:(1)手性碳原子一定是饱和碳原子;(2)手性碳原子所连接的四个基团要是不同的;
B、HS-和HCl均是含18个电子,含有一个极性键;
C、用带静电的有机玻璃棒靠近下列液体的细流,若细流偏转,则细流是极性分子,不偏转则是非极性分子,据此即可解答;
D、己烷分子式为C6H14,据此判断共价键即可.
解答 解:A、CH3CH(NO2)COOH中从左数第二个碳分别连接甲基、H原子、硝基和羧基,为手性碳原子,故A正确;
B、HS-和HCl都只含一个极性键,都具有18个电子,故B正确;
C、CH2Cl2分子结构不对称,属于极性分子,用带静电的有机玻璃棒靠近,发生偏转,故C错误;
D、己烷分子式为C6H14,含有共价键数为6-1+14=19,故1mol己烷含有的共价键数目为19NA,故D正确;
故选C.
点评 本题主要考查的是手性碳原子、极性分子与非极性分子、共价键的判断等,有一定难度.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的 金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应 生成氢气 | 高温下氢气能还原氧化 铁得到铁 | Ⅰ对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁和铁的某些化合物可用作催化剂 | Ⅰ错;Ⅱ对;无 |
| D | 在空气中铁的表面能形 成致密的氧化膜 | 铁不能与氧气反应 | Ⅰ对;Ⅱ对;有 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| B. | 常温下,在18g18O2中含有NA个氧原子 | |
| C. | 1 mol乙烷中含有C一H的键数为7×6.02×l023 mol-1 | |
| D. | 1mol-OH所含的电子数目为7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 常温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液:Fe2+、Mg2+、NO${\;}_{3}^{-}$、Cl- | |
| C. | 含有大量Al3+的溶液:Na+、Cl-、AlO${\;}_{2}^{-}$、OH- | |
| D. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO${\;}_{4}^{2-}$、S2-、SO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度越高,镁与水反应的速率越快 | |
| B. | 镁与水反应的化学方程式为:Mg+2H2O═Mg(OH)2+H2↑ | |
| C. | 氢氧化镁显碱性,且在水中有一定的溶解性 | |
| D. | 氢氧化镁是离子化合物,它的电子式可表示为: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

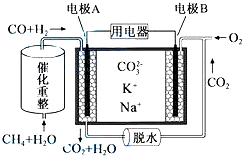
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com