
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A. | 最高价氧化物的水化物的碱性:A<C | |
| B. | B、D形成的化合物的溶于水形成B2D3溶液 | |
| C. | A、E形成的化合物只含离子键和极性键 | |
| D. | E的单质可以从D的氢化物中置换出D单质 |
分析 在短周期主族元素中,元素的最高正化合价与其族序数相等,非金属元素负化合价数值=族序数-8,由元素的化合价可知,D、E都有-2价,而D有+6价且原子半径较大,则D为S元素、E为O元素;A、B、C化合价分别为+1、+3、+2,则分别处于IA族、ⅢA族、ⅡA族,C的原子半径小于硫,故C为Be元素,原子半径A、B均大于硫,则B为Al,且A、B原子半径相差较大,故A为Na,结合元素周期律解答.
解答 解:在短周期主族元素中,元素的最高正化合价与其族序数相等,非金属元素负化合价数值=族序数-8,由元素的化合价可知,D、E都有-2价,而D有+6价且原子半径较大,则D为S元素、E为O元素;A、B、C化合价分别为+1、+3、+2,则分别处于IA族、ⅢA族、ⅡA族,C的原子半径小于硫,故C为Be元素,原子半径A、B均大于硫,则B为Al,且A、B原子半径相差较大,故A为Na,
A.同周期自左而右金属性减弱、同主族自上而下金属性增强,故金属性Na>Be,最高价氧化物的水化物的碱性:Na>Be,故A错误;
B.B、D形成的化合物为Al2S3,不溶于水,且在溶液中发生水解,故B错误;
C.A、E形成的化合物如为Na2O2,则既含离子键又含有非极性共价键,故C错误;
D.非金属性O>S,氧气可氧化硫化氢生成硫,故D正确.
故选D.
点评 本题考查了原子结构和元素性质,明确元素化合价、原子半径与原子结构的关系是解本题关键,再结合元素周期律分析解答,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B、C、D的离子半径大小比较:C>D>B | |
| B. | 元素E的最高价氧化物对应水化物的酸性比D的强 | |
| C. | 元素B分别与A、C形成的化合物中化学键的类型完全相同 | |
| D. | 均含A、B、C、D四种元素的化合物X和Y在溶液中可发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:丁>丙>乙>甲 | |
| B. | 乙元素只能形成一种二元含氧酸 | |
| C. | 另一个化合物G与B具有相同的元素组成,G是一种常见的强氧化剂 | |
| D. | 1.0L 0.1 mol/L E溶液中阴离子的总的物质的量小于0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
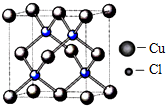 碱式碳酸铜[2CuCO3•Cu(OH)2]可用于制造烟火等.在较低温度下,将Cu(NO3)2饱和溶液倒入一定浓度的Na2CO3溶液中,即有碱式碳酸铜生成.
碱式碳酸铜[2CuCO3•Cu(OH)2]可用于制造烟火等.在较低温度下,将Cu(NO3)2饱和溶液倒入一定浓度的Na2CO3溶液中,即有碱式碳酸铜生成.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
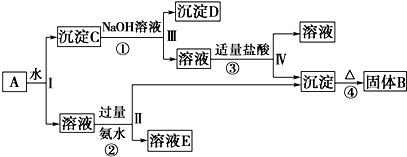
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀盐酸中滴加浓氨水:c(Cl-)=c(NH4+)+c(NH3•H2O) | |
| B. | 向NH4HSO4溶液中加入NaOH固体:c(Na+)>c(SO42-)>c(NH4+) | |
| C. | 向CH3COONa溶液中通入HCl气体:c(Na+)>c(Cl-)=c(CH3COOH) | |
| D. | 向KOH溶液中通入SO2气体:c(K+)=2c(SO32-)+c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
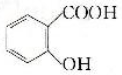 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
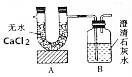 已知某燃料含有碳、氢、氧三种元素.为了测定该燃料的结构,现将1.04g燃料放人足量的氧气中充分燃烧,经测定消耗氧气1.568L(已转换为标准状况),并使产生的气体全部通人如图所示的装置,得到如表所示的实验数据(假设产生的气体被完全吸收,且没有空气进人该装置).
已知某燃料含有碳、氢、氧三种元素.为了测定该燃料的结构,现将1.04g燃料放人足量的氧气中充分燃烧,经测定消耗氧气1.568L(已转换为标准状况),并使产生的气体全部通人如图所示的装置,得到如表所示的实验数据(假设产生的气体被完全吸收,且没有空气进人该装置). | 实验前 | 实验后 | |
| A装置的质量 | 101.1g | 102.18g |
| B装置的质量 | 312.0g | 314.2g |
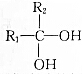 →
→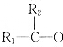 +H2O
+H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com