
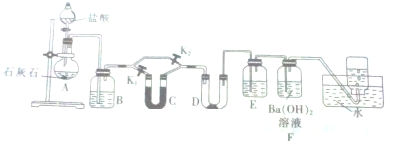
分析 碳酸钙与稀盐酸反应生成二氧化碳,二氧化碳通过盛有饱和碳酸氢钠溶液的洗气瓶,除去杂质HCl,再通过干燥管C干燥,或者不通过C直接进入盛有过氧化钠的D中,E中的盛有浓硫酸可以防止F中的水蒸气进入D中干扰实验,用氢氧化钡溶液吸收多余的二氧化碳,最后用排水法收集氧气;
(1)碳酸钙与稀盐酸反应生成二氧化碳、氯化钙和水;装置B的作用是吸收二氧化碳中的杂质HCl;F中的水蒸气进入D中会干扰实验;用氢氧化钡溶液吸收多余的二氧化碳;
(2)由分析可知,U形管C是干燥二氧化碳;根据装置D中的现象来确定CO2与Na2O2之间的反应是否需要在潮湿的条件下进行,则二氧化碳通过干燥管C干燥,或者不通过C直接进入盛有过氧化钠的D中,看D中固体颜色变化来判断.
解答 解:(1)碳酸钙与稀盐酸反应生成二氧化碳、氯化钙和水,反应的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑;
装置B的作用是吸收二氧化碳中的杂质HCl,所以B中的试剂为饱和碳酸氢钠;F中的水蒸气进入D中会干扰实验,所以E中中盛有浓硫酸以便防止F中的水蒸气进入D中与过氧化钠反应;最后用排水法收集生成的氧气,其中多余的二氧化碳要用氢氧化钡溶液吸收,则F的作用是吸收多余的CO2;
故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;饱和碳酸氢钠;防止F中的水蒸气进入D;吸收多余的CO2;
(2)由分析可知,U形管C是干燥二氧化碳,则C中的试剂是碱石灰;打开K1,关闭K2,二氧化碳先进入U形管C中干燥,再进入D中,若D中过氧化钠固体的颜色不变,说明干燥的二氧化碳与过氧化钠不反应;打开K2,关闭K1,二氧化碳不通过C直接进入盛有过氧化钠的D中,D中过氧化钠固体的颜色由浅黄色变为白色,则湿润的二氧化碳气体与过氧化钠能发生反应;
故答案为:碱石灰;K1,K2,D中过氧化钠固体的颜色不变;K2,K1,D中过氧化钠固体的颜色由浅黄色变为白色.
点评 本题考查了过氧化钠的有关性质的探究实验,侧重于考查反应装置、除杂装置、干燥装置、反应原理等,综合性比较强,题目难度中等.主要考查学生的实验探究能力和分析问题、解决问题的能力.


科目:高中化学 来源: 题型:多选题
| A. | 常温下,1L0.1mol/L的NH4NO3溶液中氮原子总数为0.2 NA | |
| B. | 1mol羟基中电子数为10NA | |
| C. | 乙二醇与钠的在反应中,每生成1molH2消耗乙二醇1mol | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②⑥ | B. | 只有③⑥ | C. | 只有③④ | D. | 只有⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率通常用单位时间内反应物或生成物的物质的量浓度变化来表示 | |
| B. | 化学反应速率是衡量化学反应进行快慢程度的物理量 | |
| C. | 用不同物质的浓度变化表示同一时间内、同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比 | |
| D. | 若某化学反应的反应速率为0.5mol/(L•s),就是指在1s内反应物和生成物的浓度变化都为0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C、B、E、D、A | B. | B、D、A、C、E | C. | C、D、E、A、B | D. | C、E、B、D、A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
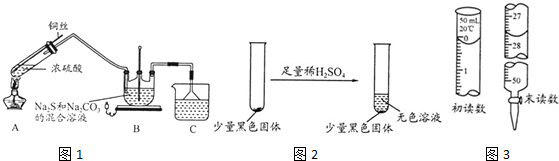
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
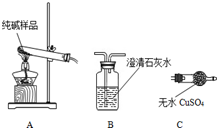 某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:
某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:| 选择的装置 (填编号) | 实验现象 | 实验结论 |
| AB或AC或ACB | B变浑浊或C变蓝或C变蓝、B变浑 | 样品含 NaHCO3 |
| 温度(℃) | 10 | 20 | 30 | 50 | 70 | 80 | 100 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 | 9.6 | 10.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个氢氧化铁胶粒的质量为107g | |
| B. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| C. | 在50g质量分数为46%的乙醇水溶液中,含有的氢原子总数为3NA | |
| D. | 在密闭容器中,0.5molH2和0.5molN2充分反应后得不到NA个NH3分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com