
| A、利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
| B、提倡人们购物时不用塑料袋,是为了防止白色污染 |
| C、为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| D、凡含有食品添加剂的食物对人体健康均有害,不可食用 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
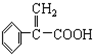
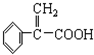 )及高聚物F.
)及高聚物F.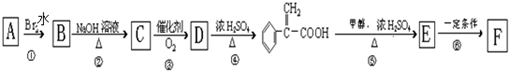
 具有相同官能团且属于芳香族化合物的同分异构体有
具有相同官能团且属于芳香族化合物的同分异构体有 的任意一个同分异构体的结构简式
的任意一个同分异构体的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
3 2 |
3 2 |
4 2 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,若电解5min时铜电极质量增加2.16g,试回答:
如图所示,若电解5min时铜电极质量增加2.16g,试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com