
【题目】某密闭容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,达到化学平衡状态,下列说法正确的是( )
2NH3(g)ΔH<0,达到化学平衡状态,下列说法正确的是( )
A.其他条件不变时,增大c(N2),H2的平衡转化率增大
B.其他条件不变时,降低温度,n(NH3)减小
C.其他条件不变时,增大压强,该反应的平衡常数增大
D.其他条件不变时,升高温度,该反应的化学反应速率加快
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.c(H+)=![]() 的溶液一定呈中性
的溶液一定呈中性
B.将水加热,KW增大,pH不变,仍呈中性
C.向水中加入少量碳酸氢钠固体,溶液的c(H+) 增大,KW不变
D.向0.1mol·L-1醋酸溶液中加水,溶液中水电离产生的c(H+)将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素,![]() 为地壳中含量最高的过渡金属元素,
为地壳中含量最高的过渡金属元素,![]() 与
与![]() 同主族,
同主族,![]() 与
与![]() 同周期,且
同周期,且![]() 与
与![]() 的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
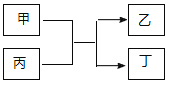
A.![]() 、
、![]() 形成的一种化合物具有漂白性
形成的一种化合物具有漂白性
B.![]() 、
、![]() 形成的离子化合物可能含有非极性键
形成的离子化合物可能含有非极性键
C.![]() 的单质能与丙反应置换出
的单质能与丙反应置换出![]() 的单质
的单质
D.丁为黑色固体,且1mol甲与足量丙反应转移电子3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。室温下,下列关于 1 L 0.1 mol/L FeCl3 溶液的说法中正确的是
A.溶液中含有的 Fe3+离子数目为 0.1NA
B.加入 Cu 粉,转移电子数目为 0.1NA
C.加水稀释后,溶液中 c(OH-) 减小
D.加入 0. 15 mol NaOH 后,3c(Fe3+)+c(H+) = c(Na+) + c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧锌锰电池含有锌、锰元素,主要含有ZnO、ZnMn2 O4、MnO、Mn2 O3、Mn3 O4、MnO2。利用废旧锌锰电池回收锌和制备二氧化锰、硫酸的工艺流程如图:
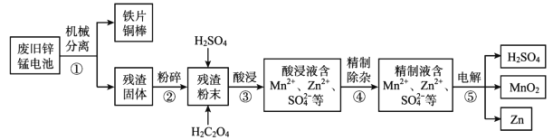
回答下列问题:
(1)步骤②“粉碎”的主要目的是______。
(2)步骤③“酸浸”发生了一系列反应:
ZnO+ H2SO4= ZnSO4 + H2O;MnO+ H2SO4= MnSO4 + H2O;
ZnMn2O4+2H2SO4=ZnSO4 + MnSO4 +2H2O+MnO2;
MnO2 + H2SO4 + H2C2O4=MnSO4 + 2CO2 ↑+2H2O。
推测 Mn2O3 与硫酸反应的离子方程式为______。
(3)如图分别表示“酸浸”时选用不同浓度硫酸和草酸对 Zn、Mn 浸出率的影响。
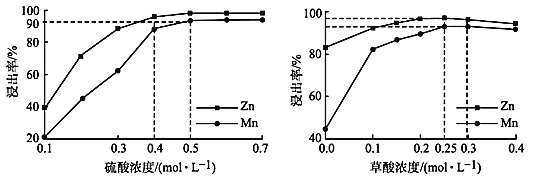
①为保证 Zn、Mn 的浸出率均大于 90%,步骤③需控制的 c(H2SO4) = ____mol/L。H2C2O4 浓度对 Mn 的浸出率影响程度大于 Zn,其原因是_____。
②假设“酸浸”所得溶液中Zn2+、Mn2+浓度相等。当 c(H2C2O4)>0.25 mol/L 时,Zn、Mn 的浸出率反而下降、且Zn 的浸出率下降先于Mn,其原因可能是_____(填序号)。
a.随着反应进行 c(H+)降低
b.Zn2+、Mn2+与 C2O42- 生成沉淀
c.溶解度:ZnC2O4<MnC2O4
(4)步骤⑤用惰性电极电解 ZnSO4 、MnSO4 的混合溶液,除生成 Zn、MnO2、H2SO4 外, 还可能生成 H2、O2 或其混合物。
①生成 MnO2 的电极反应式为_____ 。
②若 n (H2) :n (O2)=2:1,则参加反应的 n (Zn2+):n (Mn2+) = ______。
③该工艺流程中可循环利用的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究氧化铜与硫的反应并分析反应后的固体产物,设计如下实验装置。
(1)如图连接实验装置,并_____。
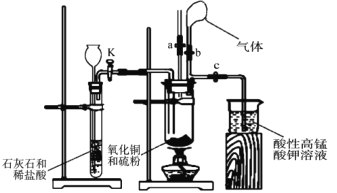
(2)将氧化铜粉末与硫粉按 5:1 质量比混合均匀。
(3)取适量氧化铜与硫粉的混合物装入大试管中,固定在铁架台上,打开_____ 和止水夹 a 并______,向长颈漏斗中加入稀盐酸,一段时间后,将燃着的木条放在止水夹 a 的上端导管口处,观察到木条熄灭,关闭活塞 K 和止水夹 a,打开止水夹 b。该实验步骤的作用是______,石灰石与稀盐酸反应的离子方程式为___________________。
(4)点燃酒精灯,预热大试管,然后对准大试管底部集中加热,一段时间后,气球膨胀, 移除酒精灯,反应继续进行。待反应结束,发现气球没有变小,打开止水夹 c,观察到酸性高锰酸钾溶液褪色后,立即用盛有氢氧化钠溶液的烧杯替换盛装酸性高锰酸钾溶液的烧杯,并打开活塞 K。这样操作的目的是__________________。
(5)拆下装置,发现黑色粉末混有砖红色粉末。取少量固体产物投入足量氨水中,得到无色溶液、但仍有红黑色固体未溶解,且该无色溶液在空气中逐渐变为蓝色。查阅资料得知溶液颜色变化是因为发生了以下反应:4[Cu(NH3)2]+ + O2+8NH3 H2O=4[Cu(NH3)4]2++4OH-+6H2O。
①经分析,固体产物中含有Cu2O。Cu2O 溶于氨水反应的离子方程式为______。
②仍有红色固体未溶解,表明氧化铜与硫除发生反应 4CuO + S![]() 2Cu2O+SO2外,还一定发生了其他反应,其化学方程式为_________。
2Cu2O+SO2外,还一定发生了其他反应,其化学方程式为_________。
③进一步分析发现 CuO 已完全反应,不溶于氨水的黑色固体可能是_____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯碱工业的说法中,正确的是( )
A.用离子交换膜法制烧碱可获得较纯净的产品,且不会对环境造成污染
B.总的离子方程式为2Cl-+2H2O=Cl2↑+2OH-+H2↑
C.当阳极附近有0.8mol NaOH生成时,导线中就有0.8mol电子通过
D.电解饱和食盐水可生产盐酸,也可以生产“84”消毒液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证次氯酸光照分解的产物,某同学采用三种传感器分别测得氯水光照过程中pH、Cl-浓度、![]() 体积分数的变化,实验数据如图所示,下列叙述错误的是( )
体积分数的变化,实验数据如图所示,下列叙述错误的是( )
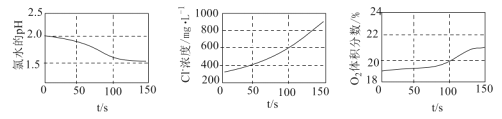
A.从0 s到150 s,溶液pH降低的原因是![]() 的电离程度增大
的电离程度增大
B.从0 s到150 s,溶液中![]() 增加到起始浓度的
增加到起始浓度的![]() 倍
倍
C.从50 s到150 s,![]() 的平均生成速率约为
的平均生成速率约为![]()
D.![]() 光照分解的产物有
光照分解的产物有![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能进行如图所示的多种反应。
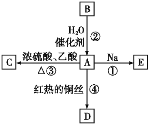
(1)A的官能团名称是_______________________,B的结构简式是________。
(2)反应②的反应类型为______________。
(3)写出反应③的化学方程式:_____________________。
(4)写出反应④的化学方程式:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com