
| A. | 硬铝 | B. | 黄铜 | C. | 钢铁 | D. | 金箔 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
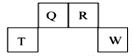 短周期元素Q、R、T、W在元素周期表中位置如图所示,其中T所处的周期序数与主族序数相等,
短周期元素Q、R、T、W在元素周期表中位置如图所示,其中T所处的周期序数与主族序数相等, ,R的最简单氢化物的电子式为
,R的最简单氢化物的电子式为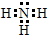 ,Q的1:1型氢化物中相对分子质量最小的分子是直线型分子(立体构型).
,Q的1:1型氢化物中相对分子质量最小的分子是直线型分子(立体构型).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O2?2SO3),反应过程中的能量关系可用如图简单表示(图中的△H 表示生成1mol产物的数据). 下列说法正确的是( )
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O2?2SO3),反应过程中的能量关系可用如图简单表示(图中的△H 表示生成1mol产物的数据). 下列说法正确的是( )| A. | S8的燃烧热△H=-a kJ•mol-1 | |
| B. | 1 mol SO2和过量 O2反应可释放出 b kJ 的热量 | |
| C. | 已知1个S8分子中有8个S-S,S=O的键能为d kJ•mol-1,O=O的键能为e kJ•mol-1,则S8分子中S-S的键能为(2d-a-e) kJ•mol-1 | |
| D. | 若使用V2O5作催化剂,当SO2(g)转化生成1mol SO3(g)时,释放的热量小于b kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{14}$ mol-1 | B. | $\frac{a}{28}$ mol-1 | C. | 14a mol-1 | D. | 28a mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全错 | B. | 只有④正确 | C. | ①③④正确 | D. | ①②③正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Va>10Vb | B. | Vb=10Va | C. | Vb<10Va | D. | Vb>10Va |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
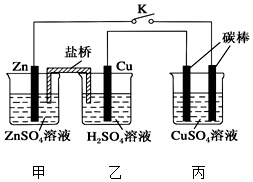 用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )
用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )| A. | 乙烧杯中铜棒为正极,其电极反应式为2H++2e-═H2↑ | |
| B. | 丙烧杯右侧碳棒为阴极,其电极表面有红色物质析出 | |
| C. | 反应时盐桥中的阴离子向甲烧杯移动 | |
| D. | 导线中通过电子的物质的量为0.1 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com