
| ��� | �缫���� | �������Һ | ������ָ��ƫת���� |
| 1 | Mg��Al | ϡ���� | ƫ��Al |
| 2 | Al��Cu | ϡ���� | ƫ��Cu |
| 3 | Al��ʯī | ϡ���� | ƫ��ʯī |
| 4 | Mg��Al | NaOH��Һ | ƫ��Mg |
| 5 | Al�� Cu | Ũ���� | ƫ��Al |
���� ��1��ʵ��1�е�����ָ��ƫ��Al����AlΪ������ʵ��2�е�����ָ��ƫ��Cu��CuΪ������
��2��ʵ��5�У�����Cu��Ũ����ĵ�ط�Ӧ��
��� �⣺��1���ɵ����ķ����֪��ʵ��1�У�������ԭ��Ӧ�����ڽ���þ��ϡ����֮�䣬ʧ���ӵ��ǽ���þ��Ϊ����������ʵ��2�У�������ԭ��Ӧ�����ڽ�������ϡ����֮�䣬ʧ���ӵ��ǽ�������Ϊ�����������ʴ�Ϊ��D��
��2��ʵ��5��Al��Ũ���ᷢ���ۻ�������Cu��Ũ�����������ԭ��Ӧ��Cu��������Al������������Cuʧȥ��������п���ӣ�������ӦΪCu-2e-=Cu2+������������õ��������ɶ�����������������ӦΪ4H++2NO3-+2e-=2NO2��+2H2O���ܷ�ӦΪCu+4H++2NO3-=Cu2++2NO2��+2H2O��
�ʴ�Ϊ��Cu-2e-=Cu2+��4H++2NO3-+2e-=2NO2��+2H2O��Cu+4H++2NO3-=Cu2++2NO2��+2H2O��
���� ���⿼��ԭ��صĹ���ԭ����ʵ�飬Ϊ��Ƶ���㣬���շ�����������ԭ��Ӧ����ط�Ӧ�Ĺ�ϵΪ���Ĺؼ������ط�����ʵ�������Ŀ��飬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��A2��B2��������֮�ʹ������ɵ�2AB������������Ӧ���� | |
| B�� | ��A2��B2��������֮��С�����ɵ�2AB������������Ӧ���� | |
| C�� | ���÷�ӦΪ���ȷ�Ӧ����Q1+Q2��Q3 | |
| D�� | ���÷�ӦΪ���ȷ�Ӧ����Q1+Q2��Q3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | �����Լ����ѧʽ�� | ���ӷ���ʽ |
| ��Mg��OH��2��Al��OH��3�� | ||
| ��NaHCO3��Һ��Na2CO3�� | ||
| ��FeCl2��Һ��FeCl3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������������������ֱ���ȫȼ�գ����߷ų��������� | |
| B�� | ��C��s��ʯī���TC��s�����ʯ����H=+1.9KJ/mol ��֪�����ʯ��ʯī�ȶ� | |
| C�� | ��101Kpa��25��ʱ��H2��ȼ����Ϊ��H=-285.8KJ/mol��������ȼ�յ��Ȼ�ѧ����ʽΪ��2H2��g��+O2��g���T2H2O��g����H=-285.8KJ/mol | |
| D�� | ϡ��Һ�У�H+��aq��+OH-��aq���TH2O��l����H=-57.3KJ/mol��������0.5 mol H2SO4��Ũ��Һ�뺬1 mol NaOH����Һ��ϣ��ų�����������57.3KJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ԫ�� | B�� | �ǽ���Ԫ�� | ||
| C�� | ϡ������Ԫ�� | D�� | ��ȷ��Ϊ��һ��Ԫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��NH4��2SO3 | B�� | NH4Cl | C�� | ��NH4��2CO3 | D�� | ��NH4��3PO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
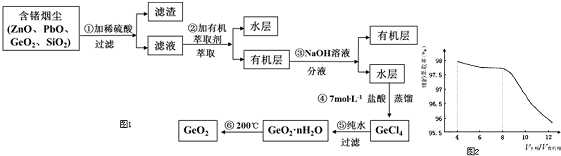
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ������ | Ag+��Na+ |
| ������ | NO3-��SO42-��Cl- |
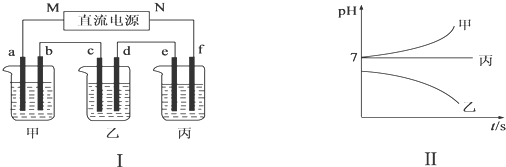
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������屻��ȫ���գ�������BaSO4���� | |
| B�� | �������屻��ȫ���գ�����BaSO3��BaSO4���� | |
| C�� | ������������ܱ����գ�û�г������� | |
| D�� | ֻ��һ�����屻���գ�����BaSO4���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com