
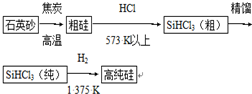
分析 (1)①纯SiHCl3与氢气反应生成硅和氯化氢;
②依据原子个数守恒结合化合价变化写出方程式;
(2)A.硅与氢氧化钠反应生成硅酸钠和氢气;
B.硅与盐酸不反应;
C.玻璃为混合物,不存在固定的熔点;
D.二氧化硅为光导纤维的主要成分;
(3)盐酸的酸性强于硅酸,盐酸与硅酸钠反应生成硅酸沉淀和氯化钠;
(4)用于人体器官的陶瓷,应具有良好的生物性能,据此分析.
解答 解:(1)①纯SiHCl3与氢气反应生成硅和氯化氢,方程式为:SiHCl3+H2 $\frac{\underline{\;1375K\;}}{\;}$Si+3HCl;
②SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气,化学方程式为:SiHCl3+3H2O=H2SiO3↓+H2↑+3HCl↑;
故答案为:SiHCl3+3H2O=H2SiO3↓+H2↑+3HCl↑;
(2)A.硅与氢氧化钠反应生成硅酸钠和氢气,可以被强碱溶液腐蚀,故A正确;
B.硅与盐酸不反应,故B错误;
C.玻璃为混合物,不存在固定的熔点,故C错误;
D.二氧化硅为光导纤维的主要成分,故D正确;
故选:AD;
(3)盐酸的酸性强于硅酸,盐酸与硅酸钠反应生成硅酸沉淀和氯化钠,离子方程式:生成白色絮状沉淀,Na2SiO3+2HCl=2NaCl+H2SiO3↓;
故答案为:生成白色絮状沉淀,Na2SiO3+2HCl=2NaCl+H2SiO3↓;
(4)用于人体器官的陶瓷,应具有良好的生物性能,
故选B.
点评 本题考查了硅及其化合物的性质和用途,熟悉物质的化学性质是解题关键,注意相关知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | HCO3- | B. | Cl- | C. | SO32- | D. | SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白色沉淀为ZnS,而黑色沉淀为CuS | |
| B. | 利用该原理可实现一种沉淀转化为更难溶的沉淀 | |
| C. | 该过程破坏了ZnS的溶解平衡 | |
| D. | 上述现象说明ZnS的Ksp小于CuS的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;CaCl2
;CaCl2 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用待测液润洗滴定用的锥形瓶 | |
| B. | 配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸 | |
| C. | 用稀盐酸洗涤盛放过石灰水的试剂瓶 | |
| D. | Na2CO3溶液保存在带玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液 | B. | NaOH溶液 | C. | KNO3溶液 | D. | AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,含4molHCl的浓盐酸与足量的MnO2反应可生成22.4L氯气 | |
| B. | 标准状况下,2.24L H2O中含有H2O分子数为0.1NA | |
| C. | 1L 0.1mol/L NaHSO4溶液中含有的阳离子数目为0.1NA | |
| D. | 实验室所制得的1.7g NH3中含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 | B. | CH3COONa | ||
| C. | NaOH和CH3COONa的混合物 | D. | NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com