
【题目】电化学知识在物质制备领域的应用前景看好。

(1)从环境保护的角度看,制备一种新型多功能水处理剂 高铁酸钠(Na2FeO4)较好的方法为电解法,其装置如图①所示:
①电解过程中阳极的电极反应式为______________________;
②“镁一次氯酸盐”燃料电池可为图①装置提供电能,该电池电极为镁合金和铂合金,其工作原理如图②所示。b为该燃料电池的___________(填“正"或“负")极。当有16.6 g Na2FeO4生成时消耗C1O-的物质的量为______mol;
(2)电解Na2SO4溶液生产H2SO4和烧碱的装置如图③所示(已知:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过),其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2。则丁为_________;电解一段时间,当产生0.1 mo1气体甲时,通过离子交换膜f的离子的质量为_____________g。
(3)用0.1032 mol/L的NaOH溶液滴定未知浓度的稀盐酸,实验数据如下表:
实验序号 | 消耗NaOH溶液的体积/mL | 待测稀盐酸的体积/mL |
1 | 28.84 | 25.00 |
2 | 27.83 | 25.00 |
3 | 27.85 | 25.00 |
根据表格计算c(HCl)=______________。在上述滴定过程中,若滴定前碱式滴定管下端尖嘴中无气泡,滴定后有气泡,则测定结果将__________ (填“偏大”、“偏小”或“不影响”)。
【答案】Fe+8OH--6e-===FeO42-+4H2O 正 0.3 NaOH 9.2 0.1149mol/L 偏小
【解析】
根据原电池及电解池原理分析解答;根据酸碱滴定原理计算溶液浓度及进行误差分析。
(1)①根据图示①知铁丝作阳极,阳极失电子发生氧化反应,电极反应式为:Fe+8OH--6e-===FeO42-+4H2O;
②如图②所示,b极发生的反应为ClO-生成Cl-,氯元素化合价降低,得电子发生还原反应,作电池的正极;Na2FeO4中铁元素化合价为+6,根据得失电子守恒得:
n(C1O一)=3×n(Na2FeO4)=3×![]() =0.3mol,
=0.3mol,
故答案为:Fe+8OH--6e-===FeO42-+4H2O;正;0.3;
(2)根据图③,电解Na2SO4溶液相当于电解水生成氢气和氧气,由题干知气体甲与气体乙的体积比约为1:2,则甲为氧气,c极为阳极,乙为氢气,d极为阴极;d极电极反应为:2H2O+2e-=H2↑+2OH-,则丁为NaOH;生成0.1mol氧气时,转移的电子的物质的量为0.4mol,根据得失电子守恒,通过交换膜f的Na+的物质的量为0.4mol,则m(Na+)=23g/mol×0.4mol=9.2g,
故答案为:NaOH;9.2;
(3)第一组数据误差较大,应该舍去,则V(NaOH)=(27.83 mL +27.85 mL)/2=27.84 mL,根据HCl+NaOH═NaCl+H2O计算:27.84mL×0.1032mol/L=25.00mL×c(HCl),解得:c(HCl)=0.1149mol/L;若滴定前碱式滴定管下端尖嘴中无气泡,滴定后有气泡,消耗掉的氢氧化钠体积就会偏小,滴定结果偏小,
故答案为:0.1149mol/L;偏小。


科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]是一复盐,在造纸等方面应用广泛。某兴趣小组采用10.0g废易拉罐(含90%的Al,还含有少量的Fe、Mg等杂质)制备明矾的实验方案如下:
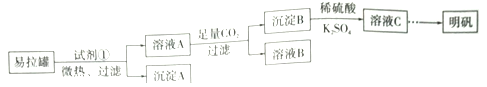
(1)试剂①应选用_____________(填代号)。
a.盐酸 b.H2SO4溶液 c.氯化钠溶液 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为____________________。
(3)溶液B中溶质的主要成分为____________________ (填化学式)。
(4)从溶液C中得到明矾的实验操作步骤为蒸发浓缩、__________(填操作名称)、过滤、洗涤、干燥。如下图所示,蒸发操作中的一处错误是_____________。

(5)该小组在实验完成之后,得到118.5 g明矾,则明矾的回收率为_____________。(已知:明矾的摩尔质量为474g·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项反应对应的图像正确的是
A. 保持温度不变,向BaSO4饱和溶液中加入硫酸钠固体
保持温度不变,向BaSO4饱和溶液中加入硫酸钠固体
B. 向少量氯化铁溶液中加入铁粉
向少量氯化铁溶液中加入铁粉
C.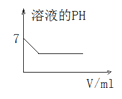 25℃时,向亚硫酸溶液中通入氯气
25℃时,向亚硫酸溶液中通入氯气
D.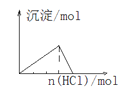 向NaAlO2溶液中通入HCl气体
向NaAlO2溶液中通入HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)醇的官能团的名称是_____。
(2)某气态有机物相对于氢气的密度为14,则其结构简式为_____。
(3)某有机物的结构简式如图所示,则其一氯代物共有_____种。

(4)新戊烷用系统命名法命名应为_____。
(5)分别将等物质的量的C3H8、C4H8完全燃烧,消耗氧气质量多的是_____(填分子式)。
(6)下列最简式中,只能代表一种有机物的有_____(选填对应的序号)。
①CH3 ②CH2 ③CH2O ④CH4O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质在水溶液中存在各种行为,如电离、水解、沉淀溶解,据所学知识回答下列问题:
(1)t℃时,纯水中c(H+)=1×10-6 mol·L-1, 该温度下,pH=10的Ba(OH)2溶液的物质的量浓度为_________ mol·L-1。
(2)25℃时,将 a mol·L-1 的醋酸和 b mol·L-1 的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=__________ mol·L-1,a_______ b(填“﹥”、“﹤”或“=”)。
(3)工业上采取用氨水除去SO2,已知25 ℃,NH3 H2O的Kb=1.8×10-5,H2SO3的 Ka1=1.3 × 10一2,Ka2=6.2 × 10一8。若氨水的浓度为2.0 mo1/ L,溶液中的c(OH-)=_____ mo1/ L;将SO2通入该氨水中,当c(OH-)降至2.0 × 10一6mo1/ L时,溶液中的![]() =_____________。
=_____________。
(4)将AgCl分别放入:①5 mL水 ②10 mL 0.1 mol·L-1 MgCl2溶液③40 mL 0.3mol·L-1 盐酸溶液中溶解至溶液饱和 ④20 mL 0.5mol·L-1 NaCl溶液 ,各溶液中Ag+的浓度分别为a、b、 c、d,它们由大到小的排列顺序是____________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 为阿伏加德罗常数的值,下列说法不正确的是( )
A.0.l mol Cl2与足量的铁粉充分反应转移的电子数为 0.2 NA
B.1.0 mol CH4 与Cl2 在光照下反应生成的 CH3Cl 分子数为 1.0 NA
C.标准状况下,11.2 L甲烷和乙烯(C2H4)混合物中含氢原子数目为2 NA
D.0.1mol Cl2 通入水中,HClO、Cl-、ClO-粒子数之和小于 0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置或操作进行相应实验,能达到实验目的的是
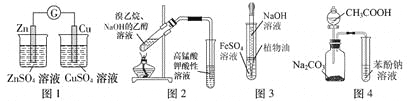
A. 用图1装置验证化学能转化为电能
B. 用图2装置检验溴乙烷与NaOH醇溶液共热产生的乙烯
C. 用图3装置制备氢氧化亚铁
D. 用图4装置证明酸性:CH3COOH>H2CO3>苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合韧是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为_______,该能层具有的原子轨道数为_____;
(2)液氨是富氢物质,是氢能的理想载体,利用![]() 实现储氢和输氢。下列说法正确的是________;
实现储氢和输氢。下列说法正确的是________;
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH4+与PH4+、CH4、BH4-、ClO4-互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.[Cu(NH3)4]2+离子中,N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是________;
II.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示。
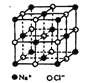
(1)设氯化钠晶体中Na+与跟它最近邻的Cl-之间的距离为r,则该Na+与跟它次近邻的C1-个数为______,该Na+与跟它次近邻的Cl—之间的距离为_____;
(2)已知在氯化钠晶体中Na+的半径为以a pm,Cl-的半径为b pm,它们在晶
体中是紧密接触的,则在氯化钠晶体中离子的空间利用率为_____;(用含a、b的式子袁示)
(3)纳米材料的表面原子占总原子数的比例很大,这是它有许多特殊性质的原因。假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞的10倍,则该氯化钠颗粒中表面原子占总原子数的百分比为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在周期表中位置关系如图所示。
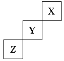
(1)X元素的单质分子式是___。若X核内中子数与质子数相等,X单质的摩尔质量是___。
(2)Y单质的电子式是___。
Y单质与水反应的化学方程式:___。
Z与钠形成的化合物的电子式是:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com