

| LiAlH4 |

 ,B的结构简式为:
,B的结构简式为: ;B和甲醇发生酯化反应生成C,则C的结构简式为:
;B和甲醇发生酯化反应生成C,则C的结构简式为: ;B分子中含有2个羧基,与乙二醇发生缩聚反应生成高分子化合物G,则G的结构简式为:
;B分子中含有2个羧基,与乙二醇发生缩聚反应生成高分子化合物G,则G的结构简式为: ;根据已知信息可知C生成D,则D的结构简式为:
;根据已知信息可知C生成D,则D的结构简式为: ,D发生催化氧化生成E,则E的结构简式为
,D发生催化氧化生成E,则E的结构简式为 ,E在双氧水的作用下生成F,据此分析解答.
,E在双氧水的作用下生成F,据此分析解答. ,则B的结构简式为:
,则B的结构简式为: ;B和甲醇发生酯化反应生成C,则C的结构简式为:
;B和甲醇发生酯化反应生成C,则C的结构简式为: ;B分子中含有2个羧基,与乙二醇发生缩聚反应生成高分子化合物G,则G的结构简式为:
;B分子中含有2个羧基,与乙二醇发生缩聚反应生成高分子化合物G,则G的结构简式为: ;根据已知信息可知C生成D,则D的结构简式为:
;根据已知信息可知C生成D,则D的结构简式为: ,D发生催化氧化生成E,则E的结构简式为
,D发生催化氧化生成E,则E的结构简式为 ,E在双氧水的作用下生成F,
,E在双氧水的作用下生成F, 、
、 ,
, ;
; ;
; +2 CH3OH
+2 CH3OH| 浓H2SO4 |
| △ |
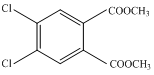 +2H2O,
+2H2O, +2 CH3OH
+2 CH3OH| 浓H2SO4 |
| △ |
 +2H2O;
+2H2O; ,其中含氧官能团是醛基,可以用银氨溶液或新制氢氧化铜悬浊液检验醛基,其现象是试管壁附着光亮的银或出现砖红色沉淀,
,其中含氧官能团是醛基,可以用银氨溶液或新制氢氧化铜悬浊液检验醛基,其现象是试管壁附着光亮的银或出现砖红色沉淀, ,
, .
.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
| A、10 mL 20 mol?L-1浓硫酸与足量锌反应,转移电子数为0.2NA |
| B、0.1 mol24Mg18O晶体中所含中子总数为2.0 NA |
| C、在标准状况下,2.8g N2和2.24L CO所含电子数均为1.4NA |
| D、1 L 1 mol?L-1的NaClO溶液中含有ClO-的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3- | H2SO4 | O2- | 35Cl |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6种 | B、7种 | C、8种 | D、9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将Na2O2放入水中发生的反应:Na2O2+2H2O=2Na++2OH-+O2↑ | ||||
| B、除去CuSO4溶液中的Fe3+:2 Fe3++3Cu=2Fe+3Cu2+ | ||||
| C、在KOH溶液中,甲烷-氧气燃料电池放电时的反应:CH4+2O2+2OH-=CO32-+3H2O | ||||
D、电解饱和食盐水制备H2和Cl2:2Cl-+2H+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,有关粒子浓度关系比较正确的( )
在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,有关粒子浓度关系比较正确的( )| A、在A、B间任意一点,溶液中一定都有c(Na+)>cCH3COO-)>c(OH-)>c(H+) |
| B、在B点,a>12.5,且有c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C、在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、在D点:c(CH3COO-)+c(CH3COOH)=2 c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要 储氢材料.
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要 储氢材料.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、m=1 n=4 |
| B、m=1 n=5 |
| C、m=2 n=5 |
| D、m=2 n=4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com