
某种纯净水生产线的主要工艺流程如图:
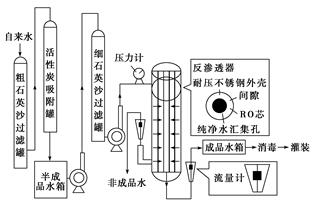
阅读该纯净水生产线的有关资料后回答问题:
资料:反渗透器的核心部件是RO芯,RO芯是由多层反渗透复合膜组成的,原用于太空宇航员进行废水再生。RO芯的孔径很小,大约是普通细菌的1/600,细小固体,有机物杂质不能透过,简单离子、水可以通过。生产时为保证成品的质量,通常控制水压使成品产率在50%左右。
RO芯部分工作参数如下:
|
硬度 |
铁 |
游离氯 |
有机物 |
… |
|
<1.7 mg·L-1 |
<0.1 mg·L-1 |
0.1 mg·L-1 |
<1 mg·L-1 |
… |
(1)纯净水一定是不含任何杂质的水吗?
(2)许多食品、饮料都以大肠杆菌的含量作为卫生标准之一,主要原因是什么?
(3)水中的Ca2+和Mg2+是引起水的硬度的主要因素,硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其质量折算成Ca2+的质量,以1 L水中含有的CaO的质量来表示。可用一定浓度的Y溶液进行滴定,Y跟Ca2+和Mg2+都以等物质的量完全反应。该工厂现用地下水生产纯净水,取地下水样品25.0 mL,用0.0100 mol·L-1 Y溶液滴定,完全反应时消耗Y溶液15.0 mL。试判断该地下水是否可直接用来生产纯净水?
(1)纯净水也可能含有少量的杂质。
(2)①人类的粪便中约有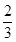 为大肠杆菌;②它的含量反映了饮水等被污染的程度。
为大肠杆菌;②它的含量反映了饮水等被污染的程度。
(3)336 mg·L-1,不符合要求。
【解析】
试题分析:(1)纯净水也可能含有少量的杂质。
(2)①人类的粪便中约有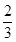 为大肠杆菌;②它的含量反映了饮水等被污染的程度。
为大肠杆菌;②它的含量反映了饮水等被污染的程度。
(3)设钙离子的物质的量为x
Ca2+ + Y  CaY2+
CaY2+
1 mol 1 mol
x 0.0100 mol·L-1×15.0×10-3 L
解得:x=1.5×10-4 mol
则1 L水中含有钙离子的物质的量=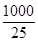 ×1.5×10-4
mol
×1.5×10-4
mol
进一步可计算出氧化钙的质量=56
g/mol×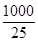 ×1.5×10-4 mol=336 mg。
×1.5×10-4 mol=336 mg。
考点:考查纯净水的有关计算、判断和应用
点评:本题为一道关于水及污水处理的综合题,其中前面三问可根据教材中的知识进行类比回答,而第四问则需要列式计算。纯净水是含有少量杂质的水,所以也是软水;食品和饮料最容易受到的污染就是大肠杆菌,它反映了饮用水被污染的程度。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
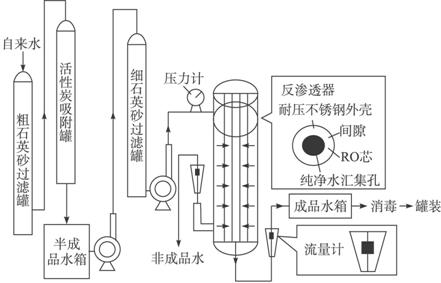
图2-6
阅读该纯净水生产线的有关资料后回答问题:
资料:反渗透器的核心部件是RO芯,RO芯是由多层反渗透复合膜组成的,原用于太空宇航员进行废水再生。RO芯的孔径很小,大约是普通细菌的1/600,细小固体,有机物杂质不能透过,简单离子、水可以通过。生产时为保证成品的质量,通常控制水压使成品产率在50%左右。
RO芯部分工作参数如下:
硬度 | 铁 | 游离氯 | 有机物 | …… |
<1.7 mg·L-1 | <0.1 mg·L-1 | 0.1 mg·L-1 | <1 mg·L-1 | …… |
(1)纯净水一定是不含任何杂质的水吗?__________________________________________________________________
(2)许多食品、饮料都以大肠杆菌的含量作为卫生标准之一,主要原因是什么?__________________________________________________________________
(3)纯净水的国家标准中,“霉菌、酵母菌”为“不得检出”,“大肠杆菌”为“≤3 MPN/100 mL”,主要原因是什么?__________________________________________________________________
(4)水中的Ca2+和Mg2+是引起水的硬度的主要因素,硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其质量折算成Ca2+的质量,以1 L水中含有的CaO的质量来表示。可用一定浓度的Y溶液进行滴定,Y跟Ca2+和Mg2+都以等物质的量完全反应。该工厂现用地下水生产纯净水,取地下水样品25.0 mL,用0.010 0 mol·L-1 Y溶液滴定,完全反应时消耗Y溶液15.0 mL。试判断该地下水是否可直接用来生产纯净水?__________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)乙的化学式为_________,丙可能的化学式为_________。Y的水溶液显(填“酸”“碱”或“中”) _________性。
(2)X的水溶液显碱性的原因(用离子方程式表示) _____________________________________,乙在水中的电离方程式为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期中考试化学试卷(解析版) 题型:填空题
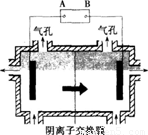
(9分)某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:
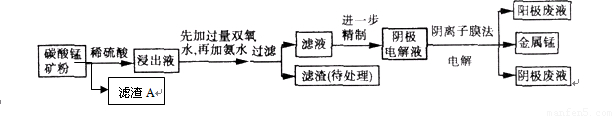
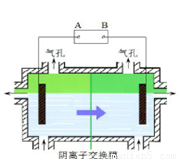
阴离子膜法电解装置如下图所示:
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式: 。
(2)已知Ksp
(Fe(OH)3) = 4 ´10–38,假设溶液中Fe3+离子浓度为0.1 mol·L–1,则开始生成Fe(OH)3
沉淀的pH是_________,沉淀完全的pH是_________。(可能用到的数据:lg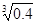 =
-0.1 lg
=
-0.1 lg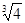 =0.2)
=0.2)
(3)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
|
离子 |
Fe3+ |
A13+ |
Fe2+ |
Mn2+ |
Mg2+ |
|
开始沉淀的pH |
1.2 |
3.7 |
7.0 |
7.8 |
9.3 |
|
沉淀完全的pH |
3.7 |
4.7 |
9.6 |
9.8 |
10.8 |
加氨水调节溶液的pH等于6,则“滤渣(待处理)”的成分是 (写化学式),滤液中含有的阳离子有H+和 (写符号)。
(4)在浸出液里锰元素只以Mn2+的形式存在,且滤渣A中也无MnO2,请用离子方程式解释原因: 。
(5)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为 。
(6)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省宜春市高三上学期第五次月考理综化学试卷(解析版) 题型:填空题
某种碳酸锰矿的主要成分有MnCO3 、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:
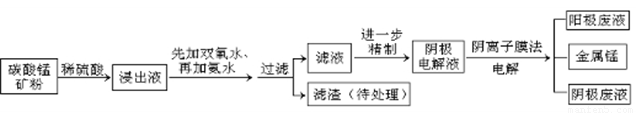
阴离子膜法电解装置如图所示:
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式 。
(2)在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,请解释原因 .
(3)(5分)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
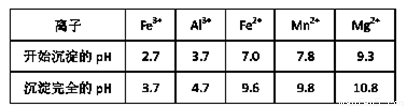
加氨水调节溶液的pH等于6,则滤渣的成分是 ,滤液中含有的阳离子有H+和 。
(4)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为 。
(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资浪费,写出该副反应的电极反应式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com