

分析 (1)基态${\;}_{\;}^{18}$O原子中含8个电子,电子排布式为1s22s22p4,据此判断;同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素的第一电离能大于相邻元素;
(2)根据光气(COCl2)分子的结构式为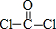 判断;根据C形成C-C及C=O键判断杂化类型;电负性强的O原子与水中的O-H易形成氢键;水中的O原子(3)根据Se在周期表中与氧、硫同主族判断位置;根据Se原子核外有34个电子书写基态核外电子的排布式;
判断;根据C形成C-C及C=O键判断杂化类型;电负性强的O原子与水中的O-H易形成氢键;水中的O原子(3)根据Se在周期表中与氧、硫同主族判断位置;根据Se原子核外有34个电子书写基态核外电子的排布式;
(4)利用均摊法确定其化学式;晶体的熔沸点较低为分子晶体;
(5)根据最上面面心上的Se2-确定距离最近且相等的Rb+的离子数目.
解答 解:(1)基态${\;}_{\;}^{18}$O原子中含8个电子,电子排布式为1s22s22p4,1s、2s各有1对自旋方向相反的电子,2p也有1对自旋方向相反的电子,所以核外存在3对自旋方向相反的电子;
同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素的第一电离能大于相邻元素,所以N、O、F这几种元素的第一电离能由小到大的顺序是O<N<F,故答案为:3;O<N<F;
(2)光气(COCl2)分子的结构式为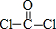 ,故光气(COCl2)分子中碳氧原子间的共价键的键型是1个σ键、1个π键;如图1为氧化石墨烯的结构示意图,其中C形成C-C及C=O键,所以C原子以sp2、sp3杂化;水中的O电负性较强,吸引电子能力的强,易与氧化石墨烯中的O-H上的H形成氢键,氧化石墨烯中O与水中的H形成氢键,所以氧化石墨烯中可与H2O形成氢键的原子有O、H;
,故光气(COCl2)分子中碳氧原子间的共价键的键型是1个σ键、1个π键;如图1为氧化石墨烯的结构示意图,其中C形成C-C及C=O键,所以C原子以sp2、sp3杂化;水中的O电负性较强,吸引电子能力的强,易与氧化石墨烯中的O-H上的H形成氢键,氧化石墨烯中O与水中的H形成氢键,所以氧化石墨烯中可与H2O形成氢键的原子有O、H;
故答案为:1个σ键、1个π键;sp2、sp3;O、H;
(3)Se在周期表中与氧、硫同主族,位于元素周期表中的第四周期第ⅥA族;Se原子核外有34个电子,基态核外电子的排布式为1s22s22p63s23p63d104s24p4,故答案为:第四周期第ⅥA族;1s22s22p63s23p63d104s24p4;
(4)该晶胞中镍原子个数=8×$\frac{1}{8}$=1,Te原子个数=2,则该晶胞中镍和碲原子个数之比为1:2,则其化学式为:NiTe2,分子晶体的熔沸点较低,又Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为-19.3℃,所以该物质为分子晶体,故答案为:NiTe2;分子晶体;
(5)白色球都在晶胞内部,所以该晶胞中含有白色球个数=8,黑色球个数=$\frac{1}{8}$×8+6×$\frac{1}{2}$=4,所以Se2-为黑色球,Rb+为白色球,则由图片知最上面面心上的Se2-距离最近且相等的Rb+的离子数目是8,故答案为:8.
点评 本题侧重物质结构与性质的考查,把握杂化类型、成键方式、氢键形成及晶胞均摊法计算为解答的关键,注重高考高频考点的考查,题材新颖,较好体现学生分析能力、知识迁移应用能力,题目难度中等.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度相同的溶液中所含溶质的微粒数相同 | |
| B. | 氢氧根离子的摩尔质量是17克 | |
| C. | 0.1摩HCl气体约含6.02×1022个HCl分子 | |
| D. | 在标准状况下,1摩SO3的体积约22.4升 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熟石膏的化学式:2CaSO4•H2O | B. | 明矾的化学式:KAlSO4•12H2O | ||
| C. | 氨分子的结构式: | D. | NH4H的电子式: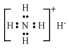 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与稀硫酸混合:Ba2++SO42-→BaSO4↓ | |
| B. | 铁粉溶于稀硫酸中:2Fe+6H+→2Fe3++3H2↑ | |
| C. | 氨水与盐酸混合:OH-+H+→H2O | |
| D. | 硫化钠溶液中滴加硝酸银:S2-+2Ag+→Ag2S↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙溶于醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 铜溶于硫酸酸化的H2O2溶液:Cu+2H++H2O2═Cu2++2H2O | |
| C. | 少量SO2通入氨水中:SO2+NH3•H2O═NH4++HSO3- | |
| D. | 向A12(SO4)3溶液中加少量Ba(OH)2溶液:Al3++SO42-+Ba2++3OH-═BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 均为0.84 L | B. | 均为0.56 L | C. | ①>② | D. | ①<② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
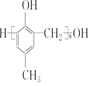 )的合成路线如图:
)的合成路线如图: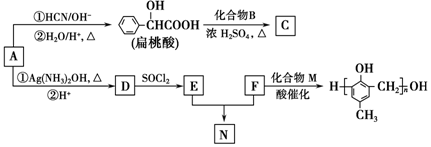
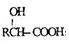
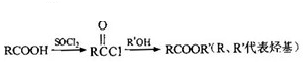
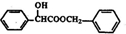 .
. )有多种同分异构体.属于甲酸酯且含酚羟基和亚甲基(-CH2-)的同分异构体共有3种,写出其中一种同分异构体的结构简式
)有多种同分异构体.属于甲酸酯且含酚羟基和亚甲基(-CH2-)的同分异构体共有3种,写出其中一种同分异构体的结构简式 (任意一种)..
(任意一种)..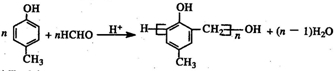
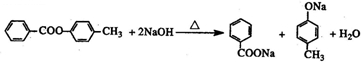 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮及其化合物在工农业生产中具有重要作用.
氮及其化合物在工农业生产中具有重要作用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com