
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |


科目:高中化学 来源: 题型:
| A、25°C时,1L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
| B、标准状况下,1molCF4中含有的电子对数目为4.0NA |
| C、1L 0.5mol?L-1 的H2SO3溶液中含有的H+数目为NA |
| D、一定条件下1molN2与3molH2混合充分反应后生成NH3分子数小于2.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含氢元素的化合物中一定有氢键 |
B、因为分子间存在氢键的缘故,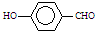 比 比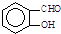 熔沸点高 熔沸点高 |
| C、由于氢键比范德华力强,所以H2O分子比H2S分子稳定 |
| D、“可燃冰”--甲烷水合物(例如:8CH4?46H2O)中CH4与H2O之间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三处 | B、四处 | C、五处 | D、六处 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入粉末质量/g | 13.68 | 27.36 | 34.20 |
| 生成气体的体积(标准状况)/L | 2.912 | 5.824 | 6.720 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑤ | B、②④ | C、②④⑤ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨生产过程中升高温度可加快反应速率,缩短生产周期,故温度越高越好 |
| B、硫酸工业中,使用催化剂是为了提高SO2转化为SO3的转化率 |
| C、电解精炼铜时,精铜作阴极 |
| D、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
查看答案和解析>>
科目:高中化学 来源: 题型:
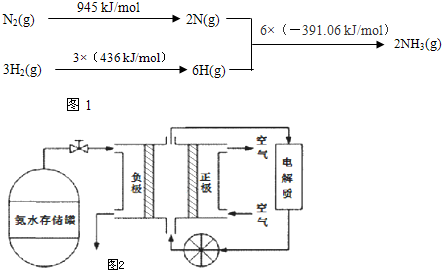
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com