
| A、NH4HCO3和盐酸的反应是放热反应 |
| B、NH4HCO3和盐酸的反应是吸热反应 |
| C、反应物的总能量高于生成物的总能量 |
| D、反应的热化学方程式为:NH4HCO3+HCl═NH4Cl+CO2↑+H2O△H=+Q kJ/mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液 |
| B、0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液 |
| C、pH=4的醋酸溶液和pH=10的氢氧化钠溶液 |
| D、pH=4的盐酸和pH=9的氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、①②④ |
| C、②③⑤ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
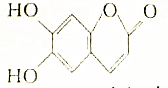 有如图所示的有机物,根据该有机物的结构回答:
有如图所示的有机物,根据该有机物的结构回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油裂化得到的汽油是纯净物 |
| B、天然气是一种较为清洁的化石燃料 |
| C、石油产品都可用于聚合反应 |
| D、水煤气是指煤气中含有一定量的水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CH4 | C2H2 | H2 | |
| 燃烧热/kJ/mo | 890.3 | 1299.6 | 285.8 |
| A、-C≡C-的键角为120° |
| B、2H2(g)+O2(g)-2H2O(g)△H=-571.6 kj?mol-l |
| C、C-H键键长小于H-H键 |
| D、2CH4(g)=C2H2(g)+3H2(g)△H=+376.4 kj?mol-l |
查看答案和解析>>
科目:高中化学 来源: 题型:
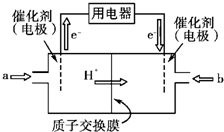 开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图所示:通入a气体的电极是原电池的
开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图所示:通入a气体的电极是原电池的查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
| A、上述反应中,每生成1molN2则转移电子6mol |
| B、上述反应瞬间产生大量高温气体推动航天飞机飞行 |
| C、反应从能量变化上说,主要是化学能转变为热能和动能 |
| D、在反应中高氯酸铵既起氧化剂,又起还原剂作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com