
【题目】金属镓有“电子工业脊梁”的美誉,镓及其化合物应用广泛。
(1) 镓(Ga)的原子结构示意图为 ,镓元素在周期表中的位置是_______。
,镓元素在周期表中的位置是_______。
(2)镓能与沸水剧烈反应生成氢气和氢氧化镓,该反应的化学方程式是______________。
(3)氮化镓在电和光的转化方面性能突出,是迄今理论上光电转化效率最高的材料。
资料:镓的熔点较低(29.8℃),沸点很高(2403℃)。
①传统的氮化镓(GaN)制备方法是采用GaCl3与NH3在一定条件下反应,该反应的化学方程式是____________________。
②当代工业上固态氮化镓(GaN)的制备方法是利用镓与NH3在1000℃高温下合成,同时生成氢气,每生成l mol H2时放出10.27 kJ热量。该可逆反应的热化学方程式是 ____________________________________。
③在密闭容器中,充入一定量的Ga与NH3发生上述反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。
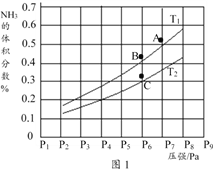
图中A点和C点化学平衡常数的关系是:KA_____ KC (填“>”“=”或“<”),理由是_____________________________。
(4)电解法可以提纯粗镓,具体原理如图2所示:
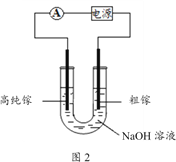
①粗镓与电源____极相连。(填“正”或“负”)
②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电的电极反应式是
_____________________________。
【答案】 第四周期第III A族 2Ga+6H2O ==== Ga(OH)3+3H2↑ Ga +NH3 ![]() GaN+3HCl 2 Ga(l)+2NH3(g)
GaN+3HCl 2 Ga(l)+2NH3(g) ![]() 2 GaN(s)+3H2(g) △H=—30.81kJ/mol KA< KC 其他条件一定时温度升高,平衡逆向移动,K减小 正 GaO2-+3e- +2H2O====Ga+4OH-
2 GaN(s)+3H2(g) △H=—30.81kJ/mol KA< KC 其他条件一定时温度升高,平衡逆向移动,K减小 正 GaO2-+3e- +2H2O====Ga+4OH-
【解析】(1) 根据镓(Ga)的原子结构示意图为 ,镓元素在周期表中的位置是第四周期第III A族;(2)镓能与沸水剧烈反应生成氢气和氢氧化镓,反应的化学方程式是2Ga+6H2O =Ga(OH)3+3H2↑;(3)①GaCl3与NH3在一定条件下反应生成氮化镓(GaN),反应的化学方程式是Ga +NH3
,镓元素在周期表中的位置是第四周期第III A族;(2)镓能与沸水剧烈反应生成氢气和氢氧化镓,反应的化学方程式是2Ga+6H2O =Ga(OH)3+3H2↑;(3)①GaCl3与NH3在一定条件下反应生成氮化镓(GaN),反应的化学方程式是Ga +NH3 ![]() GaN+3HCl;②当代工业上固态氮化镓(GaN)的制备方法是利用镓与NH3在1000℃高温下合成,同时生成氢气,每生成l mol H2时放出10.27 kJ热量。则可逆反应的热化学方程式是2 Ga(l)+2NH3(g)
GaN+3HCl;②当代工业上固态氮化镓(GaN)的制备方法是利用镓与NH3在1000℃高温下合成,同时生成氢气,每生成l mol H2时放出10.27 kJ热量。则可逆反应的热化学方程式是2 Ga(l)+2NH3(g) ![]() 2 GaN(s)+3H2(g) △H=—30.81kJ/mol;
2 GaN(s)+3H2(g) △H=—30.81kJ/mol;
③图中A点和C点化学平衡常数的关系是:KA< KC,理由是其他条件一定时温度升高,平衡逆向移动,K减小;(4)①电解法可以提纯粗镓,粗镓与电源正极相连作为阳极;②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电得电子产生=Ga,电极反应式是GaO2-+3e- +2H2O====Ga+4OH-。


科目:高中化学 来源: 题型:
【题目】向稀硫酸溶液中逐渐加入氨水,当溶液中c(NH4+)=2c(SO42﹣)时,溶液的pH( )
A. 大于7 B. 等于7 C. 小于7 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法不利于环境保护的是
A. 为减少温室气体排放,应减少燃煤,大力发展新能源,如核能、风能、太阳能
B. 用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
C. 为节约垃圾处理的费用,大量采用垃圾的填埋
D. 在屋顶安装太阳能热水器为居民提供生活用热水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于“观察DNA和RNA在细胞中的分布”的实验,下列说法中正确的是( )
A. 染色时先用甲基绿染液,再用吡罗红染液
B. 用质量分数为8%的盐酸的目的之一是使DNA与蛋白质分离,并使DNA水解
C. 酒精灯烘干载玻片,可将细胞固定在载玻片上
D. 用高倍显微镜可以比较清楚地看到呈现绿色的染色体和呈现红的RNA分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联合国卫生组织认为我国使用的铁锅是有益于人类健康的理想炊具。其主要原因是( )
A. 价格便宜,不易生锈 B. 铁具有银白色光泽,导电性好
C. 烹调的食物中留有人体需要的铁元素 D. 传热慢,保温性能好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1mol/L的醋酸溶液中存在CH3COOHCH3COO﹣+H+ . 要使溶液中 ![]() 值增大,可以采取的措施是( )
值增大,可以采取的措施是( )
A.加少量烧碱固体
B.升高温度
C.加少量冰醋酸
D.加少量醋酸钠固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是氢氧燃料电池的示意图,按图中提示,下列叙述不正确的是( )

A. a电极是负极,b电极是正极
B. a电极的电极反应式为H2-2e-===2H+
C. b电极的电极反应式为4OH--4e-===2H2O+O2↑
D. 氢氧燃料电池不需要将还原剂和氧化剂全部储藏在电池内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,250C时,它们的物质的量分数随PH的变化如图所示,下列叙述错误的是
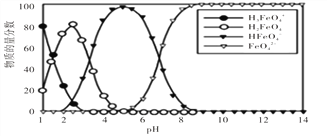
A. 向pH=5的高铁酸盐溶液中加入NaOH溶液,离子方程式为:HFeO4-+OH-=FeO42-+H2O
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2 ,K2=4.8×10-4,K3=5.0×10-8,当pH=4时,溶液中c(HFeO4-)/c(H2FeO4)=1.2
D. pH=2时,溶液中含铁粒子浓度的大小关系为:c(H2FeO4)>c(H3FeO4+)>c(HFeO4-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com