



科目:高中化学 来源: 题型:
| A、2.5×1019个 |
| B、2.5×1022个 |
| C、5×1019个 |
| D、5×1022个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
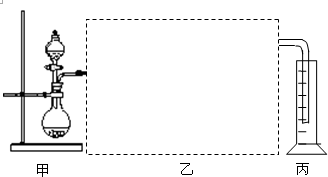
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn | B、Fe | C、Al | D、Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(HA)>c(HB) |
| B、c(A-)>c(B-) |
| C、c(H+)>c(OH-) |
| D、c(A-)+c(B-)>c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、D、P、Q、E、G八种短周期元素的原子序数依次递增.X、Y、D元素原子中电子层数与未成对电子数均相等;D、E属于同族元素,G的单质的水溶液和ED2均有漂白性.P与X同主族,Q是生活中常见的金属.
X、Y、Z、D、P、Q、E、G八种短周期元素的原子序数依次递增.X、Y、D元素原子中电子层数与未成对电子数均相等;D、E属于同族元素,G的单质的水溶液和ED2均有漂白性.P与X同主族,Q是生活中常见的金属.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
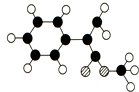
 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a>b | B、a<b |
| C、a=b | D、不能确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com