
| A. | CO2 | B. | O2 | C. | CO | D. | N2 |
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| 实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(D)=24mol•L-1•min-1 | B. | v(C)=0.5mol•L-1•s-1 | ||
| C. | v(B)=30mol•L-1•min-1 | D. | v(A)=0.15 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
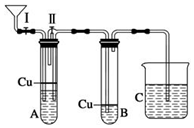 某化学课外兴趣小组为探究NO气体易被空气氧化,并观察NO气体的实际颜色,同时为了防止气体扩散污染空气,对实验室制取NO气体的装置改装如下:
某化学课外兴趣小组为探究NO气体易被空气氧化,并观察NO气体的实际颜色,同时为了防止气体扩散污染空气,对实验室制取NO气体的装置改装如下:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com