
【题目】NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用千冶金染料、皮革等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列有关说法正确的是( )
Na2S+2CO2↑。下列有关说法正确的是( )
A.12g石墨晶体中含有碳碳键的数目为3NA
B.1L0.1molL-1Na2S溶液中含阴离子的数目小于0.lNA
C.生成1mol氧化产物时转移电子数为4NA
D.常温常压下,11.2LCO2中含质子的数目为11NA
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还有少量杂质)是提取铝的原料。提取铝的工艺流程如下:
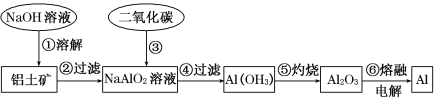
(1)请用离子方程式表示以上工艺流程中第①步反应:_____________________。
(2)写出以上工艺流程中第③步反应的离子方程式:___________________________。
(3)若第③步加入的是过量的盐酸,则发生反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(V)是人体必需的微量元素,能预防突发性心脏病等疾病,其常见化合价有+2、+3、+4、+5,实验室模拟工业生产制备V2(CO3)3的步骤如下:
I.取18.20gV2O5放入水中搅拌形成悬浊液,在酸性条件下,通入二氯化硫充分反应可得V2(SO4)3溶液;
II.将V2(SO4)3溶液与足量的碳酸钠溶液混合,充分反应后过滤,洗涤、干燥,得V2(CO3)3固体22.56g。
已知:+5价V具有氧化性,+3价V具有还原性,易被氧气氧化。
回答下列问题:
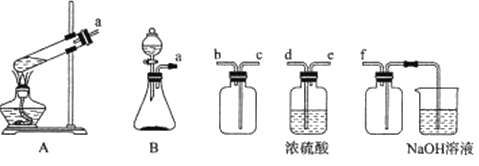
(1)实验室用Na2SO3固体和H2SO4(浓)制取SO2,可选用的发生装置是_____(填“A”或“B”),利用下述装置制取并收集干燥的SO2,连接顺序为a—____—____—____—_____—f。
(2)步骤I的装置如下;
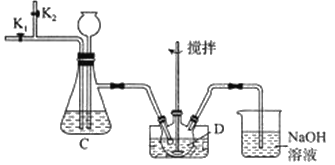
①盛放V2O5的仪器D的名称是_____,装置C中长颈漏斗的作用是_______。
②通入二氧化硫前和实验结束后都要通入N2,目的是________。
③写出步骤I中反应的离子方程式:___________。
(3)步骤II的洗涤操作中,证明已经洗净的方法是_________;实验中V2(CO3)3的产率为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法不正确的是( )
A.常温常压下,1.7gNH3含有NA个电子
B.标准状况下,22.4L水中含H2O分子NA个
C.1molNa完全反应生成NaCl时,失去NA个电子
D.常温常压下,22.4LCO2中含有的CO2分子数小于NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述中正确的是( )
A. 常温下,1 L 0.1 mol·L-1 MgCl2溶液中含Mg2+数为0.1NA
B. 常温常压下的33.6 L Cl2与27g Al充分反应,转移电子数为3 NA
C. 1mol单质铁被氧化时一定失去3NA个电子
D. 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(H2C2O4)是一种重要的化工产品。其制备工艺流程如下:
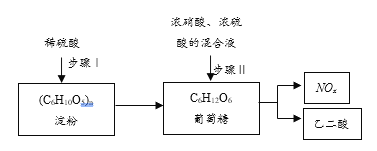
步骤Ⅱ中葡萄糖(结构简式: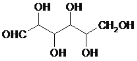 )被氧化成乙二酸,需控制反应温度为55~60℃,边搅拌边滴加浓硝酸、浓硫酸的混合液,可发生下列反应:
)被氧化成乙二酸,需控制反应温度为55~60℃,边搅拌边滴加浓硝酸、浓硫酸的混合液,可发生下列反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
(1)步骤Ⅰ中淀粉水解成葡萄糖,使用______试剂可检验淀粉是否完全水解。
(2)步骤Ⅱ的氧化过程需控制反应温度为55~60℃的原因:①温度过低,则_______________;②温度过高,则_________________。
(3)检验氧化后的溶液中是否仍含有葡萄糖的实验方案是_______________。
(4)H2C2O4能使酸性KMnO4溶液褪色,配平离子方程式并标出电子转移的方向和数目。____H2C2O4+____MnO4-+____H+→____CO2↑+____Mn2++____H2O,______________
(5)若尾气NOx中,n(NO2):n(NO)=1:2,则每生产6.3kg乙二酸会产生标准状况下_____________L的NO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯:6H2(g)+2CO2(g)![]() CH2===CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
CH2===CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )

A. 该反应的逆反应为吸热反应
B. 平衡常数:KM>KN
C. 生成乙烯的速率:v(N)一定大于v(M)
D. 当温度高于250 ℃,升高温度,催化剂的催化效率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A.甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
B.在200℃、101KPa时,H2与碘蒸气作用生成1 mol HI放出热量7.45kJ,其热化学方程式为I2(g)+H2(g)=2HI(g) ΔH=-14.9kJ/mol
C.已知在101kPa下,1gH2燃烧生成水蒸气放出121kJ热量,其热化学方程式为H2(g)+![]() O2(g)=H2O(g) ΔH=-242kJ/mol
O2(g)=H2O(g) ΔH=-242kJ/mol
D.25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,表示硫酸溶液与氢氧化钾溶液反应的中和热的热化学方程式为H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l) ΔH=-114.6kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com