
【题目】下列水解离子方程式正确的是
A. HCO3-+H2O![]() H3O++CO32- B. NH4++H2O
H3O++CO32- B. NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
C. CO32-+2H2O![]() H2CO3+2OH- D. Fe3++3H2O
H2CO3+2OH- D. Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】14g铜银合金跟足量的某浓度HNO3反应,将放出的气体与1.12LO2(标况)混合,通入水中,恰好全部吸收,则合金中铜的质量是
A.1.6gB.3.2gC.6.4gD.9.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烷烃的沸点有高到低的是( )
①甲烷②丁烷③正戊烷④异戊烷⑤新戊烷⑥辛烷
A. ①②③④⑤⑥ B. ⑥③④⑤②①
C. ⑥③④②⑤① D. ①②⑤④③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoxFe3-xO4磁粉是一种比较好的高矫顽力磁粉。以FeSO4为原料制备CoxFe3-xO4的主要步骤如下:
![]()
(1)步骤①是在FeSO4溶液中加入NaOH溶液,在40℃下搅拌生成FeOOH晶种。生成晶种的化学方程式为_____________________。
(2)步骤②将晶种移到放有FeSO4溶液和铁皮的生长槽中,升温到60℃,吹入空气,待晶种长大到一定尺寸后,过滤、水洗、干燥,得FeOOH粉末。生长槽中放入铁皮的目的是_______,吹入空气的作用为_____________________。
(3)步骤③将FeOOH在200~300℃下加热脱水,生成红色Fe2O3。实验室完成该操作需要下列仪器中的___________(填字母)。
a.蒸发皿 b.烧杯 c.坩埚 d.泥三角 e.酒精灯
(4)步骤④通入H2,加热至300~400℃,生成Fe3O4。通入H2前要向加热炉中通入N2,其作用为______________________________________________。
(5)某研究小组欲用锂离子电池正极废料(含LiCoO2、铝箔、铁的氧化物)制备CoSO4·7H2O晶体。下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Co2+ | 6.9 | 9.4 |
请完成下列实验步骤(可选用的试剂:H2O2、稀硝酸、稀硫酸、NaOH溶液):
①用N-甲基吡咯烷酮在120℃下浸洗正极废料,使LiCoO2与铝箔分离,得到LiCoO2粗品并回收铝。
② _____________________________________________________。
③向所得粗品CoSO4溶液中加入NaOH溶液,调节pH约为5,过滤。
④_______________________________________________________。
⑤将Co(OH)2沉淀溶于稀硫酸中,蒸发浓缩、降温结晶,得到CoSO4·7H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a,将其全部投入50mL bmol·L-1的硝酸溶液中,加热使其充分反应(假充NO是唯一的还原产物)。下列说法正确的是
A. 若金属有剩余,反应中转移的电子数目为2yNA
B. 若金属全部溶解,则溶液中一定含有Fe3+
C. 若金属全部溶解,且产生336mL气体(标准状况),则b=0.3
D. 当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1- a/3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研制的大型客机C919的机身大量使用铝锂合金材料。这是利用了铝锂合金性质中的( )
A.高强度、低密度B.高强度、导热性
C.低密度、导电性D.导电性、导热性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是
①Al2O3 ![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3
Al(OH)3
②S ![]() SO3
SO3 ![]() H2SO4
H2SO4
③饱和NaCl(aq)![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
④Fe2O3 ![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
⑤MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO
A. ②③④ B. ①④⑤ C. ②④⑤ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟是一种卤族元素。但它与其他卤素在单质和化合物的制备与性质上存在较明显的差异
(1)研究发现,SbF5能将MnF4从离子[MnF6]2-的盐中反应得到,SbF5转化成稳定离子[SbF6]-的盐。而MnF4很不稳定,受热易分解为MnF3和F2。根据以上研究写出以K2MnF6和SbF5为原料,在423 K的温度下制备F2的化学方程式:____________________。
(2)现代工业以电解熔融的氟氢化钾(KHF2)和氟化氢(HF)混合物制备氟单质,电解制氟装置如图所示。
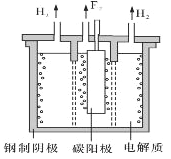
①已知KHF2是一种酸式盐,写出阴极上发生的电极反应式______________。
②电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是____________ 。
③HF的水溶液能用于蚀刻玻璃,其化学反应方程式为:_____________________。
④已知25℃时,氢氟酸(HF)的电离平衡常数Ka=3.6×10-4。某pH=2的氢氟酸溶液,由水电离出的c(H+)=_________mol/L;若将0.01 mol/L HF溶液与pH=12的NaOH溶液等体积混合,则溶液中离子浓度大小关系为:__________________。
⑤又已知25℃时,溶度积常数Ksp(CaF2)=1.46×10-10。现向1L0.2 mol/L HF溶液中加入1L0.2 mol/L CaCl2溶液,____________(填“是”、“否”) 有沉淀产生,并通过列式计算说明__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )
化学式 | CH3COOH | H2CO3 | AgCl | Ag2CrO4 |
Ka或Ksp | Ka=1.8×10-5 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ksp=1.8×10-10 | Ksp=2.0×10-12 |
A. 常温下,相同浓度①CH3COONH4 ②NH4HCO3 ③(NH4)2CO3溶液中,c(NH4+)由大到小的顺序是:①>②>③
B. AgCl 易溶于氨水难溶于水,所以AgCl 在氨水中的Ksp 大于水中的 Ksp
C. 向饱和氯水中滴加NaOH 溶液至溶液刚好为中性时,c(Na+)=2c(ClO-)+c(HClO)
D. 向浓度均为1×10-3molL-1的KCl 和K2CrO4混合液中滴加1×10-3molL-1 的AgNO3溶液,CrO42-先形成沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com