
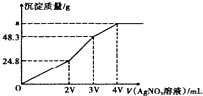
 ij�����Һ�к�������ΪNaCl��KI��Na2S��0.1mol��������Һ�ڼ���һ��Ũ�ȵ�AgNO3��Һ���������������������AgNO3��Һ������仯��ͼ��ʾ��������˵���в���ȷ���ǣ�������
ij�����Һ�к�������ΪNaCl��KI��Na2S��0.1mol��������Һ�ڼ���һ��Ũ�ȵ�AgNO3��Һ���������������������AgNO3��Һ������仯��ͼ��ʾ��������˵���в���ȷ���ǣ�������| A�� | ����AgNO3��Һ�����ʵ���Ũ��Ϊ$\frac{0.1}{V}mol•{L}^{-1}$ | |
| B�� | a����ֵΪ62.65 | |
| C�� | �����£�AgCl��AgI��AgS��ˮ���ܽ��������μ�С | |
| D�� | ��AgCl������Һ�м���NaI���壬��AgI�������� |
���� �����Һ�м���AgNO3��Һ���������ӷ�Ӧ��Ag++Cl-=AgCl����Ag++I-=AgI����2Ag++S2-=Ag2S�������������ӵ����ʵ�����ȣ�����ͼ����������ֵ������ӷ���ʽ֪��NaCl��KI��������������������Na2S������������Һ�����һ�룬����0-2V������Ӧ2Ag++S2-=Ag2S����2V-3V������ӦAg++I-=AgI����3V-4V������ӦAg++Cl-=AgCl����
A������ͼ֪��0-2Vʱ��n��Ag2S��=$\frac{24.8g}{248g/mol}$=0.1mol������Agԭ���غ����n��AgNO3��������n=CV�жϣ�
B��aΪAgCl��AgI��Ag2S��������ԭ���غ����aֵ��
C����ͬ�¶��£��ܽ��С�������ɳ�����
D���ܶȻ��������������ת��Ϊ�ܶȻ�����С�����ʣ�
��� �⣺�����Һ�м���AgNO3��Һ���������ӷ�Ӧ��Ag++Cl-=AgCl����Ag++I-=AgI����2Ag++S2-=Ag2S�������������ӵ����ʵ�����ȣ�����ͼ����������ֵ������ӷ���ʽ֪��NaCl��KI��������������������Na2S������������Һ�����һ�룬����0-2V������Ӧ2Ag++S2-=Ag2S����2V-3V������ӦAg++I-=AgI����3V-4V������ӦAg++Cl-=AgCl����
A������ͼ֪��0-2Vʱ��n��Ag2S��=$\frac{24.8g}{248g/mol}$=0.1mol������Agԭ���غ��n��AgNO3��=2n��Ag2S��=0.2mol�����������ʵ���Ũ��=$\frac{0.2mol}{��2V��1{0}^{-3}��L}$=$\frac{100}{V}$mol/L����A����
B��aΪAgCl��AgI��Ag2S����3V-4Vʱ���ɳ���AgCl������Clԭ���غ��n��AgCl��=n��NaCl��=0.1mol��m��AgCl��=0.1mol��143.5g/mol=14.35g����a=14.35+48.3=62.65����C��ȷ��
C����ͬ�¶��£��ܽ��С�������ɳ������������Ϸ���֪�����ɳ�������˳����Ag2S��AgI��AgCl�����Գ����£�AgCl��AgI��AgS��ˮ���ܽ��������μ�С����C��ȷ��
D���ܶȻ��������������ת��Ϊ�ܶȻ�����С�����ʣ��ܽ�ȳ���AgI��AgCl��������AgCl������Һ�м���NaI���壬��AgI�������ɣ���D��ȷ��
��ѡA��
���� ���⿼������ļ��㣬���ؿ������������������ȷ�������ַ����ķ�Ӧ�ǽⱾ��ؼ��������������仯ȷ�����ӷ�Ӧ�Ⱥ�˳������ԭ���غ���м��㣬�״�ѡ����A��ע�������λ���㣬Ϊ�״��㣬��Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2��3 | B�� | 2��5 | C�� | 1��2 | D�� | 1��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 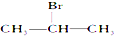 | B�� | 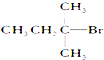 | C�� | 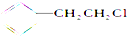 | D�� | CH3CH2Br |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ�Ӻ˶��������Ӻ����ӹ��� | |
| B�� | KClO3��SO3����ˮ���ܵ��磬��KClO3��SO3�ǵ���� | |
| C�� | ��NaAlO2��Һ�еμ�NaHCO3��Һ���г������������� | |
| D�� | ������ͭ��Ũ���ᷴӦ��NO���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Kspֻ�����ܵ���ʵ����ʺ��¶��йأ�������Һ�е�����Ũ���� | |
| B�� | ������Na2SO4��Һ���뵽����ʯ��ˮ�У��а�ɫ����������˵��Ksp[Ca��OH��2]����Ksp[CaSO4] | |
| C�� | ��֪25��ʱ��Ksp[Fe��OH��3]=4.0��10-38�����¶��·�ӦFe��OH��3+3H+?Fe3++3H2O��ƽ�ⳣ��K=4.0��104 | |
| D�� | ��֪25��ʱ��Ksp[Mg��OH��2]=1.8��10-11����MgCl2��Һ�м��백ˮ�����Һ��pH=11���������������ʱ��Һ�е�c��Mg2+��=1.8��10-5mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��CH3COONa ��Һ�е�����ɫ��̪����Һ��죺CH3COO-+H2O?CH3COOH+OH- | |
| B�� | ��Mg��OH��2��ɫ����Һ�е��뱥��FeCl3��Һ������Һ���֣�3Mg��OH��2+2Fe3+�T2Fe��OH��3��+3Mg2+ | |
| C�� | ��NaHSO3��Һ�еμ���ɫʯ����Һ����Һ��죺NaHSO3�TNa++H++SO32- | |
| D�� | ��ϡH2SO4�ữ��KMnO4��Һ�е���˫��ˮ����Һ��ɫ��2MnO4-+5H2O2+6H+�T2Mn2++5O2��+8H2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com