
| A. | Fe-3e-=Fe3+ | B. | 2Fe+2H2O+O2=2Fe(OH)2↓ | ||
| C. | 2H2O+O2+4e-=4OH- | D. | 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
分析 烧过菜的铁锅未及时洗涤(残液中含NaCl等),第二天便出现红棕色锈斑[Fe(OH)3失水的产物],是金属铁发生吸氧腐蚀的结果,正极发生的是氧气得电子的还原反应,负极是金属铁是失电子的氧化反应.
解答 解:A、金属铁发生吸氧腐蚀,负极是金属铁是失电子的氧化反应,即Fe-2e-═Fe2+,所以Fe-3e-=Fe3+不发生,故A选;
B、正极发生的是氧气得电子的还原反应,即2H2O+O2+4e-═4OH-,负极是金属铁是失电子的氧化反应,即Fe-2e-═Fe2+,Fe2++2OH-═Fe(OH)2,合并得到:2Fe+2H2O+O2═2Fe(OH)2↓,故B不选;
C、金属铁发生吸氧腐蚀,正极发生的是氧气得电子的还原反应,即2H2O+O2+4e-═4OH-,故C不选;
D、氢氧化亚铁不稳定,易被氧气氧化为氢氧化铁,即4Fe(OH)2+O2+2H2O═4Fe(OH)3,故D不选;
故选:A.
点评 本题考查了金属吸氧腐蚀的原理,注意把握原电池中正负极电极方程式的书写方法,题目难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀.溶液中一定含有大量的SO42- | |
| B. | 加入足量的CaCl2溶液,产生了白色沉淀.溶液中一定有大量的CO32- | |
| C. | 用洁净的铂丝蘸取该溶液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色.该溶液中一定含有钾离子,可能含有钠离子 | |
| D. | 先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀.溶液中一定含有大量的Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 平衡原理探究题
平衡原理探究题| 滴加试剂及量 | 所根据的现象 | 结论 |
| 是盐水解之故 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 任意比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2.4 g 金属镁变成镁离子时失去的电子数为 0.2 NA | |
| B. | 标准状况下,18 g H2O中含有NA个水分子 | |
| C. | 常温常压下,11.2 L H2和O2的混合物所含分子个数是 0.5 NA | |
| D. | 1 mol/L NaOH溶液中含有的Na+数目是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
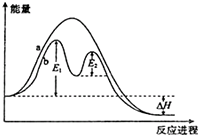
| A. | 反应过程a有催化剂参与 | |
| B. | 改变催化剂,可改变该反应的活化能 | |
| C. | 该反应为吸热反应,热效应等于△H | |
| D. | 加入催化剂,可以提升反应物的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com