
| 充电 |
| 放电 |
| A、放电时,H2SO4 浓度增加 |
| B、放电时,负极的电极反应式为:Pb+SO42--2e-=PbSO4 |
| C、在充电时,电池中每转移1mol电子,理论上生成1mol硫酸 |
| D、在充电时,阴极发生的反应是PbSO4-2e-+2H2O=PbO2+SO2-4+4H+ |


科目:高中化学 来源: 题型:
| A、称取7.68g硫酸铜,加入500ml水 |
| B、称取12.0 g胆矾配成500ml的溶液 |
| C、称取12.5g胆矾配成500ml的溶液 |
| D、称取12.5g硫酸铜,加入500ml水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和反应都是放热反应 |
| B、25℃时,将pH=5的HCl溶液稀释1000倍,其pH=8 |
| C、25℃时,AgCl在同浓度的CaCl2和NaCl溶液中的溶解度不相同 |
| D、中和浓度与体积均相同的盐酸和醋酸,消耗NaOH物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、vZ=0.05 mol?L-1?s-1 |
| B、vX.=0.025 mol?L-1?s-1 |
| C、vY=0.05 mol?L-1?s-1 |
| D、vY=0.075 mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
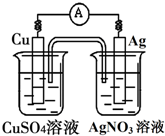 已知反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)为一自发进行的氧化还原反应,将其设计成如图所示原电池.下列说法中正确的是( )
已知反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)为一自发进行的氧化还原反应,将其设计成如图所示原电池.下列说法中正确的是( )| A、铜电极是正极,其电极反应为Cu-2e-=Cu2+ |
| B、银电极上发生还原反应,电极质量增加 |
| C、当铜电极质量减少0.64g时,电解质溶液中有0.02mol电子通过 |
| D、外电路中电子由银电极流向铜电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、电极I发生氧化反应 |
| B、相同的时间内,电极Ⅱ与Ⅳ质量变化相同 |
| C、电极Ⅲ的电极反应:4OH--4e-=2H2O+O2↑ |
D、电流方向:电极Ⅳ→ →电极I →电极I |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、36 | B、64 |
| C、108 | D、192 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com