
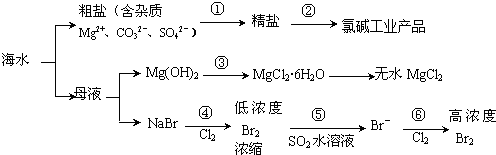
| A. | 过程①需要加入不止1种试剂,并通过合适的操作,方能把杂质除去 | |
| B. | 过程②得到的氯碱工业产品中只含有1种单质 | |
| C. | 过程③发生复分解反应 | |
| D. | 过程④、⑤、⑥均发生氧化还原反应 |
分析 海水蒸发溶剂得到粗盐和母液,粗盐通过精制得到精盐,电解饱和食盐水得到氯气、氢气和氢氧化钠;母液加氢氧化钠反应生成氢氧化镁沉淀,氢氧化镁和酸反应生成氯化镁,制得氯化镁,母液通入氯气氧化溴离子为溴单质,被二氧化硫吸收后发生氧化还原反应生成溴化氢,富集溴元素,通入氯气氧化溴化氢为溴单质得到高浓度的溴.
A.因由粗盐得到精盐,就是要除去粗盐中的杂质,除去Mg2+、CO32-、SO42- 分别用NaOH溶液、盐酸、BaCl2溶液;
B.氯碱工业生成Cl2、H2两种单质;
C.氢氧化镁和酸反应生成氯化镁,为复分解反应;
D.氧化还原反应的特征是化合价的变化,④⑥中Br-被氧化,⑤Br2被还原.
解答 解:A.过程①除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可以先加入过量的氢氧化钠溶液除去镁离子,再加入过量的氯化钡溶液除去硫酸根离子,然后加入过量的碳酸钠溶液除去钙离子和多余的氯化钡,过滤将生成的沉淀除去,此时溶液中含有过量的氢氧化钠溶液和碳酸钠溶液,可以加入适量的盐酸,调节呈中性,故A正确;
B.电解食盐水制取烧碱,反应的化学方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,同时得到氢气和氯气两种单质,故B错误;
C.过程③由氢氧化镁转化成氯化镁结晶水合物,为氢氧化镁和酸的反应,属于复分解反应,故C正确;
D.氧化还原反应的特征是化合价的变化,④⑥中发生的反应为2Br-+Cl2=2Cl-+Br2,⑤发生的反应为SO2+Br2+2H2O=H2SO4+2HBr,过程④、⑤、⑥均发生氧化还原反应,故D正确;
故选B.
点评 本题考查了海水资源综合利用,涉及了离子的除杂、氧化还原反应、元素及其化合物的有关知识进行综合利用,提高了试题的综合性,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Ca2+:1s22s22p63s23p6 | B. | O:1s22s22p6 | ||
| C. | P:1s22s22p63s23p3 | D. | Br:1s22s22p63s23p63d104s24p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点/℃ | 密度/g.cm-3 | 硬度 | 导电性 | |
| 某合金 | 2500 | 3.00 | 7.4 | 2.3 |
| 铁 | 1535 | 7.86 | 4.5 | 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可用于净水 | |
| B. | 氯水保存在棕色瓶中,并置于冷暗处 | |
| C. | 氯元素在自然界主要以氯气形式存在 | |
| D. | 氯气被广泛用于医药合成、农药生产等方面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16gO2所含氧原子个数约为6.02×1023 | |
| B. | 1molN2参加氧化还原反应时电子转移数约为3×6.02×1023 | |
| C. | 物质的量浓度为0.5mol•L-1的MgCl2溶液,含有Cl-数约为6.02×1023 | |
| D. | 常温常压下,22.4LSO2含分子的个数约为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁溶于氢碘酸中$Fe{(OH)_3}+3{H^+}=F{e^{3+}}+3{H_2}O$ | |
| B. | 次氯酸钙溶液中通入过量的二氧化碳Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | |
| C. | 向100mL 0.1moL/L的溴化亚铁溶液中通入0.015 mol的氯气$2F{e^{2+}}+4B{r^-}+3C{l_2}=2F{e^{3+}}+2B{r_2}+6C{l^-}$ | |
| D. | 向明矾溶液逐滴加入氢氧化钡溶液至铝离子刚好完全沉淀$A{l^{3+}}+S{O_4}^{2-}+B{a^{2+}}+3O{H^-}=BaS{O_4}↓+Al{(OH)_3}↓$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com