
| A. | c(OH-)=0.1mol/L的溶液:Na+、K+、CO32-、ClO- | |
| B. | 滴入酚酞显红色的溶液中:Na+、Al3+、CO32-、AlO2- | |
| C. | 含有Fe3+的溶液中:Na+、Al3+、Cl-、SCN- | |
| D. | pH=1的溶液中:Fe2+、Cl-、NO3-、K+ |
分析 A.四种离子之间不发生反应,都不与氢氧根离子反应;
B.滴入酚酞显红色的溶液中存在大量氢氧根离子,铝离子与碳酸根离子、偏铝酸根离子和氢氧根离子反应;
C.铁离子与硫氰根离子反应生成硫氰化铁;
D.pH=1的溶液为酸性溶液,硝酸根离子在酸性条件下能够氧化亚铁离子.
解答 解:A.Na+、K+、CO32-、ClO-之间不反应,都不与OH-反应,在溶液中能够大量共存,故A正确;
B.滴入酚酞显红色的溶液为碱性溶液,溶液中存在大量氢氧根离子,Al3+与CO32-、AlO2-、OH-发生反应,在溶液中不能大量共存,故B错误;
C.Fe3+和SCN-之间反应生成硫氰化铁,在溶液中不能大量共存,故C错误;
D.pH=1的溶液为酸性溶液,Fe2+、NO3-之间在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利学生灵活运用基础知识解决实际问题的能力.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
 、
、 、
、 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )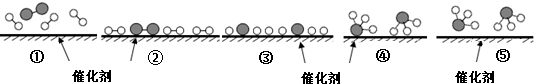
| A. | 使用催化剂,合成氨反应放出的热量减少 | |
| B. | 在该过程中,N2、H2断键形成N原子和H原子 | |
| C. | 在该过程中,N原子和H原子形成了含有非极性键的NH3 | |
| D. | 合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
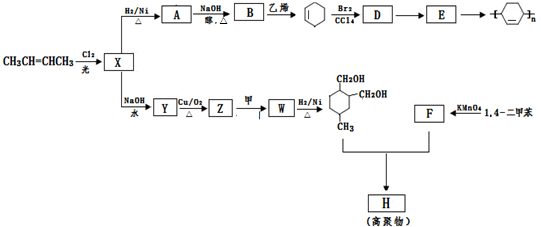
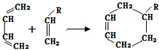 (或写成
(或写成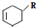 R代表取代基或氢)
R代表取代基或氢)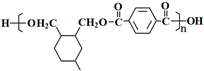 .
.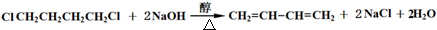 ;
;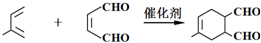 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,属于弱电解质的是H2O、Al(OH)3.
,属于弱电解质的是H2O、Al(OH)3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3- | |
| B. | 0.1 mol/L的AlCl3溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 25℃时,水电离出的c(H+)=1×l0-l3 mol/L的溶液中:K+、Ba2+、NO3-、S2- | |
| D. | 能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 古代发明 | 化学变化 |
| A | 生产陶瓷 | SiO2+CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑ |
| B | 黑火药爆炸 | S+2KNO3+3C$\frac{\underline{\;点燃\;}}{\;}$K2S+N2↑+3CO2↑ |
| C | 湿法炼铜 | CuSO4+Fe═Cu+FeSO4 |
| D | 用谷物酿酒 | (C6H10O5)n→C6H12O6→CH3CH2OH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成,它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.
已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成,它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
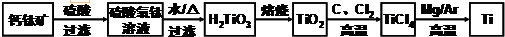
 ,其原子核外共有22种运动状态不相同的电子.金属钛晶胞如图1所示,为六方最密堆积(填堆积方式).
,其原子核外共有22种运动状态不相同的电子.金属钛晶胞如图1所示,为六方最密堆积(填堆积方式).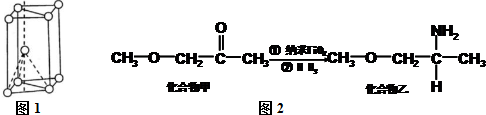

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com