

分析 (1)①除锈是用强酸与氧化铁反应;②可以通测最后一次洗涤液的PH的方法成功判断铁屑是否洗净;
(2)①硝酸根离子在酸性条件下才具有强氧化性;
②pH偏低,氢离子浓度偏大,则铁可与氢离子反应生成氢气
(3)根据图示知道t1时刻前,硝酸根离子、氢离子浓度逐渐减小,亚铁离子浓度增大,则是金属铁和硝酸之间的反应;
(4)向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,反应中只有Fe、H元素化合价发生变化,结合质量守恒、电荷守恒可写出离子方程式;
(5)①当铁炭混合物中铁的质量分数为0时,则只有碳粉,碳粉具有吸附性,可去除水中少量的Cu2+和Pb2+;
②随着铁的质量分数的增加,形成的微电池数目减少,则Cu2+和Pb2+的去除率不升反降.
解答 解:(1)①除锈是用强酸与氧化铁反应,所以离子方程式反应为:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
②铁屑洗净的方法是测最后一次洗涤液的PH的方法成功判断铁屑是否洗净,故答案为:测最后一次洗涤液的pH,若为7,则说明铁屑已洗净;
(2)①pH调至2.5,是因为硝酸在酸性条件下的氧化性强,易被铁屑还原,故答案为:硝酸在酸性条件下的氧化性强,易被铁屑还原;
②pH偏低,氢离子浓度偏大,则铁可与氢离子反应生成氢气,可导致NO3-的去除率下降,故答案为:铁粉与H+反应生成H2;
(3)根据图示知道t1时刻前,硝酸根离子、氢离子浓度逐渐减小,亚铁离子浓度增大,则是金属铁和硝酸之间的反应,即4Fe+NO3-+10H+=4Fe2++NH4++3H2O;故答案为:4Fe+NO3-+10H+=4Fe2++NH4++3H2O;
(4)向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,反应中只有Fe、H元素化合价发生变化,发生氧化还原反应,离子方程式为2Fe2++BH4-+4OH-=2Fe+2H2↑+B(OH)4-,
故答案为:2Fe2++BH4-+4OH-=2Fe+2H2↑+B(OH)4-;
(5)①当铁炭混合物中铁的质量分数为0时,则只有碳粉,可去除水中少量的Cu2+和Pb2+,原因是碳粉具有吸附性,也可起到净水的作用,
故答案为:活性炭对Cu2+和Pb2+具有吸附作用;
②随着铁的质量分数的增加,形成的微电池数目减少,反应速率减小,则Cu2+和Pb2+的去除率不升反降,
故答案为:铁的质量分数的增加,碳铁混合物中微电池数目减少.
点评 本题考查了化学方程式的书写、化学反应速率的影响因素、化学实验方案的判断等知识,题目难度较大知识点较多、综合性强,熟练掌握知识的迁移和应用是解答本题的关键,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 步骤 | 操作 | 现象 |
| 1 | 加入稀盐酸 | 溶解,无气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
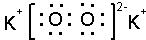 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘是人体内必须的微量元素,所以富含高碘酸的食物适合于所有人群 | |
| B. | 化石燃料不完全燃烧会产生CO造成污染,完全燃烧不会造成大气污染 | |
| C. | 利用铁比铜金属性强的性质,常用FeCl3溶液腐蚀Cu来刻制印刷电路板 | |
| D. | 中国古代利用明矾溶液清除铜镜表面的铜镑,是利用了明矾溶液的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素在人体内可以水解成葡萄糖 | |
| B. | 组成蛋白质的元素中,一定含有碳、氢、氧、氮 | |
| C. | 适量摄入油脂,有助于人体吸收多种脂溶性维生素 | |
| D. | 天然蛋白质水解后的最终产物是a-氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
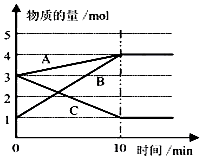 化学反应速率与限度与生产、生活密切相关
化学反应速率与限度与生产、生活密切相关| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com