
A.如图所示,测定中和热时,大小两烧杯间填满碎纸的作用只是固定小烧杯 |
| B.若用50mL 0.55mo1·L—1的氢氧化钠溶液,分别与50mL 0.50mo1·L—1的盐酸和50mL 0.25mo1·L—1的硫酸充分反应,两反应测定的中和热不相等 |
| C.在中和滴定实验中,滴定管用蒸馏水洗涤后,再用标准液润 洗,再加进标准液 |
| D.进行中和滴定操作时,左手震荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
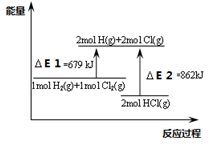
| A.△E1是该反应的活化能 |
| B.△E2是破坏2mol HCl(g)所需的能量 |
| C.该反应的热化学方程式为H2+Cl2=2 HCl△H=-183KJ/mol |
| D.该反应是一个反应物总能量高于生成物总能量的反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.需要加热才能发生的反应一定是吸热反应 |
| B.任何放热反应在常温条件下一定能发生反应 |
| C.反应物和生成物所具有的总能量决定了放热还是吸热 |
| D.C(石墨,s)=C(金刚石,s)△H>0,所以金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Q1>Q2 | B.Q1=Q 2 | C.Q1<Q2 | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H ="-2119.6" kJ/mol |
| B.C2H6(g)+5/2O2(g)=2CO2(g)+3H2O(g)△H ="-1559.8kJ/mol" |
| C.C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(g)△H ="-1559.8" kJ/mol |
| D.C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(l)△H ="-1559.8" kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 定反应过程中所放出的热量可计算中和热。试回答下列问题。
定反应过程中所放出的热量可计算中和热。试回答下列问题。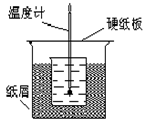
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C(s)+O2(g)="==CO(g)" ΔH ="—110.5" kJ/mol |
| B.C(s)+O2(g)===CO2(g) ΔH =-393.5 kJ/mol |
| C.2H2(g)+O2(g)===2H2O(l) ΔH =-571.6 kJ/mol |
| D.H2(g)+1/2O2(g)===H2O(g) ΔH =-241.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H
H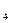 )和强氧化剂H
)和强氧化剂H O
O ,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4 mol 液态肼和足量液态H
,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4 mol 液态肼和足量液态H O
O 反应生成氮气和水蒸气时放出256.64 kJ的热量。
反应生成氮气和水蒸气时放出256.64 kJ的热量。 O
O 反应的热化学方程式 。
反应的热化学方程式 。 O(l)="===" H
O(l)="===" H O(g);△H=+44kJ/mol,则16 g液态肼与足量液态H
O(g);△H=+44kJ/mol,则16 g液态肼与足量液态H O
O 反应生成氮气和液态水时,放出的热量是_____________________。
反应生成氮气和液态水时,放出的热量是_____________________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com