
| A. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | 氨水吸收足量的SO2气体:NH3•H2O+SO2═NH4++HSO3- | |
| C. | 少量SO2通入NaClO溶液中:SO2+ClO-+H2O═SO42-+Cl-+2H+ | |
| D. | 向Fe(OH)3悬浊液中加入氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
分析 A.当n(OH-):n(Al3+)=6:2时生成2molAl(OH)3,Al(OH)3可与OH-反应生成AlO2-,以此判断n(OH-):n(Al3+)=7:2时的反应程度;
B.氨水吸收足量的SO2气体生成亚硫酸氢铵;
C.溶液呈碱性,应生成硫酸根离子和氯离子;
D.向Fe(OH)3悬浊液中加入氢碘酸,铁离子被还原,生成亚铁离子和碘.
解答 解:A.当n(OH-):n(Al3+)=6:2时生成2molAl(OH)3,Al(OH)3可与OH-反应生成AlO2-,则当n(OH-):n(Al3+)=7:2时,发生2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O,故A正确;
B.氨水吸收足量的SO2气体生成亚硫酸氢铵,反应的离子方程式为NH3•H2O+SO2═NH4++HSO3-,故B正确;
C.应发生ClO-+2OH-+SO2═Cl-+SO42-+H2O,故C错误;
D.向Fe(OH)3悬浊液中加入氢碘酸,铁离子被还原,生成亚铁离子和碘,离子方程式为2Fe(OH)3+2I-+6H+=2Fe2++6H2O+I2,故D错误.
故选CD.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、与量有关的离子反应、电解反应的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 100mL 2mol/L NH4NO3溶液 | B. | 40mL 0.5mol/L Ca(NO3)2溶液 | ||
| C. | 50mL 1.5mol/L Al(NO3)3溶液 | D. | 150mL 1mol/L Mg(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
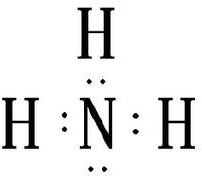 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
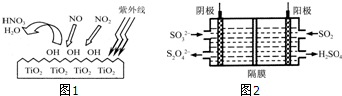
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
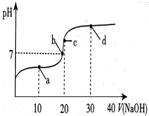 常温下,向20mL 0.1mol/L 醋酸溶液中滴加0.1mol/L NaOH溶液,溶液的pH变化如图所示.下列关于溶液中微粒浓度大小关系说法正确的是( )
常温下,向20mL 0.1mol/L 醋酸溶液中滴加0.1mol/L NaOH溶液,溶液的pH变化如图所示.下列关于溶液中微粒浓度大小关系说法正确的是( )| A. | a点时:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | b点时:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) | |
| C. | c点时:c(H+)=c(CH3COOH)+c(OH-) | |
| D. | d点时:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | A | B | C |
| 结构简式 | 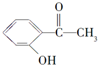 | 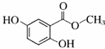 | 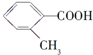 |
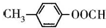
| 化合物 | D | E | F |
| 结构简式 |  | 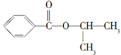 |  |
 .
.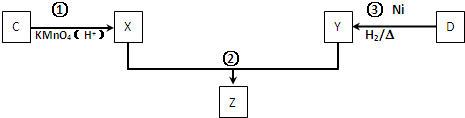
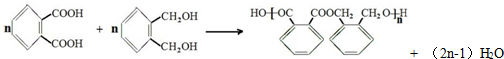 .
.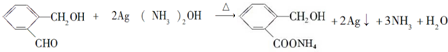 .
.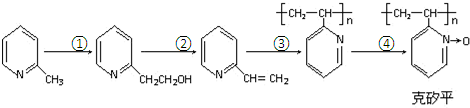
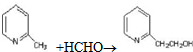 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 航天服材质是由碳化硅/陶瓷和碳纤维等复合而成,具有耐高温防寒等性能 | |
| B. | 从海水提取物质不一定都必须通过化学反应才能实现 | |
| C. | 二氧化硅可用于制备太阳能电池板,晶体硅可用于制作光导纤维 | |
| D. | 明矾可用于自来水的净化,氯气可用于自来水的杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
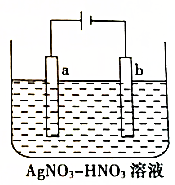 如图为电解精炼银的示意图,a(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为NO3-+e-+2H+=NO2↑+H2O.
如图为电解精炼银的示意图,a(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为NO3-+e-+2H+=NO2↑+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钠和铜的单质及其化合物在生活实际中有着广泛的应用.
钠和铜的单质及其化合物在生活实际中有着广泛的应用.| NaF | NaCl | NaBr | NaI | |
| 熔点/℃ | 993 | 801 | 747 | 661 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com