
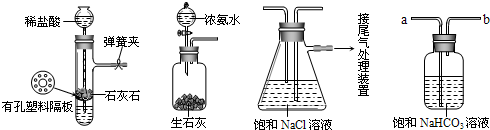
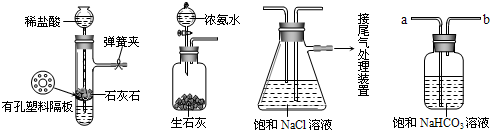
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑

 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:阅读理解
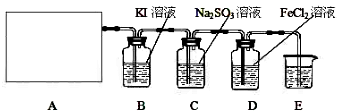
 (2011?万州区一模)硫酸工厂周围的空气中有较多的二氧化硫.某研究性学习小组为了测定空气(内含N2、O2、CO2、SO2等)中二氧化硫的体积分数设计了如下实验方案,如图是他们在测定中使用的部分装置图.
(2011?万州区一模)硫酸工厂周围的空气中有较多的二氧化硫.某研究性学习小组为了测定空气(内含N2、O2、CO2、SO2等)中二氧化硫的体积分数设计了如下实验方案,如图是他们在测定中使用的部分装置图.| 22.4m |
| 233V |
| 22.4m |
| 233V |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
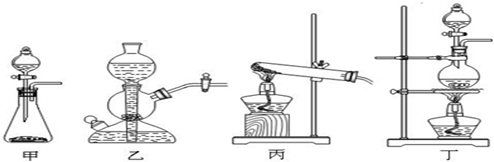
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 8000×(15-cV2) |
| V1 |
| 8000×(15-cV2) |
| V1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com