
����Ŀ���������´��ڷ�Ӧ��H2(g)+I2(g) ![]() 2HI(g) ��H<0.����������ͬ��1L���ݾ���(�����û����������)̬���������ڢ��г���lmolH2��1mol��2(g)���ڢ��г���2molHl(g).�ڢ��г���2molH2��2molI2 (g)��700�������¿�ʼ��Ӧ���ﵽƽ��ʱ������˵����ȷ����()
2HI(g) ��H<0.����������ͬ��1L���ݾ���(�����û����������)̬���������ڢ��г���lmolH2��1mol��2(g)���ڢ��г���2molHl(g).�ڢ��г���2molH2��2molI2 (g)��700�������¿�ʼ��Ӧ���ﵽƽ��ʱ������˵����ȷ����()
A. �������з�Ӧ������ͬ
B. �������з�Ӧ��ƽ�ⳣ����ͬ
C. �������е�������ɫ���������е�������ɫdz
D. ��������H2��ת��������������HI��ת��֮��С��1
���𰸡�D
��������
A���������д�����Ӧ��ʼ����ƽ�⣬�������д��淴Ӧ��ʼ���ƽ�⽨����;������ͬ��
B�����������൱������������ƽ��Ļ������ټ���1mol H2��1mol I2��g������Ӧ������Ӧ���У����������е���ƽ��ʱ�¶ȸ��ߣ��÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ���¶�Խ��ƽ�ⳣ��ԽС��
C�����������������ƽ��״̬���൱������������ƽ��Ļ����Ͻ����¶ȣ�ƽ��������Ӧ�ƶ���
D���¶���ͬʱ����������H2 ��ת��������������HI��ת����֮�͵���1�����������������ƽ��״̬���൱������������ƽ��Ļ����Ͻ����¶ȣ�ƽ��������Ӧ�ƶ���
A���������д�����Ӧ��ʼ����ƽ�⣬�������д��淴Ӧ��ʼ���ƽ�⽨����;������ͬ�����ȽϷ�Ӧ���ʣ�ѡ��A����
B�����������൱������������ƽ��Ļ������ټ���1mol H2��1mol I2��g������Ӧ������Ӧ���У����������е���ƽ��ʱ�¶ȸ��ߣ��÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ���¶�Խ��ƽ�ⳣ��ԽС��ѡ��B����
C�����������������ƽ��״̬���൱������������ƽ��Ļ����Ͻ����¶ȣ�ƽ��������Ӧ�ƶ������������е�������ɫ���������е�������ɫ�ѡ��C����
D���¶���ͬʱ������I��H2 ��ת��������������HI��ת����֮�͵���1�����������������ƽ��״̬���൱������������ƽ��Ļ����Ͻ����¶ȣ�ƽ��������Ӧ�ƶ���HI��ת���ʱ���������ͬ�¶�ʱ��������HI��ת���ʵͣ�����������H2 ��ת��������������HI��ת����֮��С��1��ѡ��D��ȷ��
��ѡD��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ⶨ![]() ��Һ�������ٽ��¹����е�
��Һ�������ٽ��¹����е�![]() ���������±���ʵ������У�ȡ�١���ʱ�̵���Һ�����������ữ��
���������±���ʵ������У�ȡ�١���ʱ�̵���Һ�����������ữ��![]() ��Һ���Ա�ʵ�飬�ܲ�����ɫ�����ࡣ����˵������ȷ����
��Һ���Ա�ʵ�飬�ܲ�����ɫ�����ࡣ����˵������ȷ����
ʱ�� | �� | �� | �� | �� |
�¶� | 25 | 30 | 40 | 25 |
| 9.66 | 9.52 | 9.37 | 9.25 |
A. ![]() ��Һ�д���ˮ��ƽ�⣺
��Һ�д���ˮ��ƽ�⣺![]()
B. �ܲ����İ�ɫ������![]()
C. �١��۵Ĺ����У�![]() �ڽ���
�ڽ���
D. �١��۵Ĺ�����,�¶���![]() ��ȣ�ǰ�߶�ˮ��ƽ���Ӱ�����
��ȣ�ǰ�߶�ˮ��ƽ���Ӱ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֳ���Ԫ�ؽṹ��Ϣ���±����Ը�����Ϣ�ش��й����⣺

��1��д��Bԭ�ӵĻ�̬�����Ų�ʽ__��
��2���������ʾʽд��A���⻯����Һ�д��ڵ����__����дһ�֣���A���⻯����ӽ��һ��H+�γ������Ӻ������__����д�������������С����������������
��3����CԪ�ص���������Һ����μ������AԪ�ص��⻯��ˮ��Һ�������ɵ������Ļ�ѧʽΪ__����Ҫ������������л�ѧ���ijɼ����__��
��4�����з��ӽṹͼ�е�������ʾ�������Ԫ�ص�ԭ���г�ȥ�������ӵ�ʣ�ಿ�֣�������ʾ��ԭ�ӣ�С�ڵ�������ʾû���γɹ��ۼ����������ӣ����߱�ʾ���ۼ���

�����Ϸ����У�����ԭ�Ӳ���sp3�ӻ��γɻ�ѧ����__����д��ţ����ڢڵķ�������__��������__������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������
A. ��NH![]() ��[Cu(NH3)4]2���ж�������λ��
��[Cu(NH3)4]2���ж�������λ��
B. 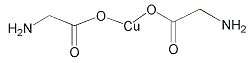 ��������������Ϊ7:1
��������������Ϊ7:1
C. C![]() ��O
��O![]() ��Ϊ�ȵ����壬1 mol O
��Ϊ�ȵ����壬1 mol O![]() �к��е�������ĿΪ2NA
�к��е�������ĿΪ2NA
D. ��֪��ӦN2O4(l)��2N2H4(l)===3N2(g)��4H2O(l)�����÷�Ӧ����4 mol N��H�����ѣ����γɵ�������ĿΪ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��R��W��ԭ���������ε��������ֶ���������Ԫ�أ���������������֮��Ϊ11������YԪ���������ͻ��ϼ۵Ĵ�����Ϊ2��Y��Z�ĵ������ɵĻ�������һ�ִ�������Ϣ�ġ���ʹ���ӡ���R��ԭ�Ӱ뾶������Ԫ�������ģ�Y��W��ͬ��Ԫ�ء�����˵��������ǣ� ��
A. �����ӵĻ�ԭ�ԣ�Y>Z
B. R�ĵ��ʿ����ǽ�����ǽ���
C. ��X��Z��W���ɵ���һ������Ԫ��
D. ��״���£�1molYZ��0.5mol![]() ��Ϻ�������������һ��С��22.4L
��Ϻ�������������һ��С��22.4L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)2017���п�Ժij�о��Ŷ�ͨ�����һ������Na-Fe3O4/HZSM-5��ܸ��ϴ������ɹ�ʵ����CO2ֱ�Ӽ�����ȡ����ֵ���ͣ����о��ɹ�������Ϊ��CO2��ת�������ͻ���Խ�չ����
��֪��H2(g)+1/2O2(g)=H2O(l) ��H1 = ��aKJ/mol
C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ��H2= ��bKJ/mol
��д��25����101kPa�����£�CO2��H2��Ӧ��������(��C8H18��ʾ)���Ȼ�ѧ����ʽ_________________________________��
(2)����CO2��H2Ϊԭ�ϣ��ں��ʵĴ���(��Cu/ZnO����)�����£�Ҳ�ɺϳ�CH3OH���漰�ķ�Ӧ�У�
�ף�CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H= �� 53.7kJ��mol-1 ƽ�ⳣ��K1
CH3OH(g)+H2O(g) ��H= �� 53.7kJ��mol-1 ƽ�ⳣ��K1
�ң�CO2(g)+H2(g) ![]() CO(g)+H2O(g) ��H= + 41.2kJ��mol-1 ƽ�ⳣ��K2
CO(g)+H2O(g) ��H= + 41.2kJ��mol-1 ƽ�ⳣ��K2
��CO(g)+2H2(g) ![]() CH3OH(g)��ƽ�ⳣ��K=______(�ú�K1��K2�ı���ʽ��ʾ)���÷�Ӧ��H_____0(��������������С����)��
CH3OH(g)��ƽ�ⳣ��K=______(�ú�K1��K2�ı���ʽ��ʾ)���÷�Ӧ��H_____0(��������������С����)��
�����CO2ת��ΪCH3OHƽ��ת���ʵĴ�ʩ��___________(��д����)��
�۴����ͷ�Ӧ��ϵ�Ĺ�ϵ��������Կ�Ĺ�ϵһ�������и߶ȵ�ѡ���ԡ���������ʵ�飬����CO2��H2��ʼͶ�ϱȾ�Ϊ1��2.2��������ͬ��Ӧʱ��(t1min)��
�¶�(K) | ���� | CO2ת����(%) | �״�ѡ����(%) | �ۺ�ѡ�� |
543 | Cu/ZnO���װ����� | 12.3 | 42.3 | A |
543 | Cu/ZnO����Ƭ���� | 11.9 | 72.7 | B |
553 | Cu/ZnO���װ����� | 15.3 | 39.1 | C |
553 | Cu/ZnO����Ƭ���� | 12.0 | 70.6 | D |
�ɱ����е����ݿ�֪����ͬ�¶��²�ͬ�Ĵ�����CO2��ת��ΪCH3OH��ѡ����������Ӱ�죬�����ϱ��������ݽ�Ϸ�Ӧԭ������������ѡ��Ϊ___________(����ĸ����)��
(3)��CO��H2Ϊԭ�Ϻϳ��״��ķ�ӦΪ��CO(g)+2H2(g)![]() CH3OH(g)���������Ϊ2L�����������ܱ����������������У��ֱ���1molCO��2molH2�����������ķ�Ӧ�¶ȷֱ�ΪT1��T2��T3�Һ㶨���䡣��ͼΪ���������еķ�Ӧ�����е�5minʱH2���������ʾ��ͼ��������һ��������Ӧһ���ﵽƽ��״̬��
CH3OH(g)���������Ϊ2L�����������ܱ����������������У��ֱ���1molCO��2molH2�����������ķ�Ӧ�¶ȷֱ�ΪT1��T2��T3�Һ㶨���䡣��ͼΪ���������еķ�Ӧ�����е�5minʱH2���������ʾ��ͼ��������һ��������Ӧһ���ﵽƽ��״̬��
��0��5minʱ��������������CH3OH��ʾ�Ļ�ѧ��Ӧ����Ϊ_________________��
������������һ���ﵽƽ��״̬��������________(��д��������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���N��S����Ⱦ�ŷ��ﲢ���ƴ��������ã������شش��������⣺
��1��![]() β�����ð�ˮ��������
β�����ð�ˮ��������![]() ����ӦΪ
����ӦΪ![]()
![]() ���ٽ�
���ٽ�![]() ����Ϊ
����Ϊ![]() ������ʵ�ָ������ʣ����Ϊ�������������������£�
������ʵ�ָ������ʣ����Ϊ�������������������£�
����1��![]()
����2��![]() ��
��
![]() ��
��
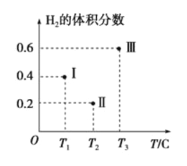
30��ʱ���ֱ�������ͬ�����м���100L 0.4![]() ��Һ������������ͬ���ʵ����������������
��Һ������������ͬ���ʵ����������������![]() ��������X��%����ʱ��ı仯��ͼ��ʾ��
��������X��%����ʱ��ı仯��ͼ��ʾ��
������ͼ���жϣ�����![]() Ϊ
Ϊ![]() ��������
��������![]() ____����������������������
____����������������С������![]() �����ܵ�ԭ����___��
�����ܵ�ԭ����___��
��60min�ڲ�÷���2��ϵ����![]() ��ʾ�ķ�Ӧ����Ϊ__
��ʾ�ķ�Ӧ����Ϊ__![]() ��
��
��2������2�У�![]() �ᱻ������
�ᱻ������![]() ����
����![]() ���ܽ�������������������Ϊ�˱����ܰ���Һ������������������
���ܽ�������������������Ϊ�˱����ܰ���Һ������������������![]() ��
��![]() ��ԭ��
��ԭ��![]() ��ͬʱ����
��ͬʱ����![]() ����Ӧ�������£�
����Ӧ�������£�
i��![]()
ii��_____
iii��![]()
iv��![]()
���ii����ӦΪ____��
��3�����÷����е�![]() ����2�������ɵ�
����2�������ɵ�![]() ��ԭ��
��ԭ��![]() ����ʵ��
����ʵ��![]() ��������Ӧ�����ӷ���ʽΪ____��
��������Ӧ�����ӷ���ʽΪ____��
![]() ������ʵ�������÷���2����������
������ʵ�������÷���2����������![]() Ϊ
Ϊ![]() �Ĺ��̣���������������������õ���___�������ӷ��ţ���
�Ĺ��̣���������������������õ���___�������ӷ��ţ���
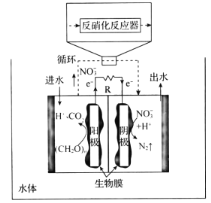
��4����������绯ѧϵͳ����������ˮ���о����ٷ�չ����ͼ��һ�����͵Ľ�ûʽ˫��������-��������ء��������Һ���������ɣ��м������ӽ���Ĥ�������������е��л�����������������������Ӻ����ӣ����е�![]() ͨ����ѭ���������ң�������������Ӧ���з������������ñ���ԭ��
ͨ����ѭ���������ң�������������Ӧ���з������������ñ���ԭ��![]() ��
��
������绯ѧϵͳ�����л�������ˮ���ŵ���____��
��д������������Ӧ�ĵ缫��Ӧʽ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A. FeCl3��Һ�еμӹ���Na2S��Һ��2Fe3++S2- ��2Fe2++S��
B. ��Na2O2����Ͷ��H218O�У�2Na2O2��2H218O ��4Na+��4OH����18O2��
C. ��NH4Al(SO4)2��Һ�е���Ba(OH)2��Һ��ǡ��ʹSO42-��ȫ������NH4+��Al3+��2SO42-��2Ba2+��4OH- �� Al(OH)3����NH3��H2O��2BaSO4��
D. ����������Ũ���ᷴӦ��MnO2+4H++4Cl- ![]() Mn2++2H2O+2Cl2��
Mn2++2H2O+2Cl2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA���������ӵ�����������˵����ȷ���ǣ� ��
A.��״���£�22.4 L CO��CO2�Ļ��������������̼ԭ����һ����NA
B.��״���£�2.24L��������ˮ������Ӧ��ת�Ƶĵ�����ĿΪ0.1 NA
C.���ʵ���Ũ��Ϊ2mol/L��BaCl2��Һ�У�����Cl-����Ϊ4NA
D.��״���£�11.2L H2O����0.5NA����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com