
| A. | 钠的密度比乙醇的大 | |
| B. | 乙醇分子中6个氢原子的化学性质完全相同 | |
| C. | 钠与乙醇的反应比钠与水的反应缓和 | |
| D. | 钠与乙醇反应产生的气体可以燃烧,燃烧前必须验纯 |
分析 A、钠和乙醇反应时,不能浮在乙醇液面上;
B、乙醇的结构简式为CH3CH2OH;
C、乙醇是非电解质;
D、钠和乙醇反应生成氢气.
解答 解:A、钠和乙醇反应时,不能浮在乙醇液面上,说明钠的密度比乙醇的大,故A正确;
B、乙醇的结构简式为CH3CH2OH,官能团为-OH,故-OH上的H原子和CH3CH2-上的H原子的性质不同,故B错误;
C、乙醇是非电解质,-OH中的H原子不能电离,而水为弱电解质,能部分电离出氢离子,故钠和乙醇的反应比钠和水的反应要缓和,故C正确;
D、钠和乙醇反应生成氢气,是可燃性气体,故点燃前必须验纯,否则易发生爆炸,故D正确.
故选B.
点评 本题考查了乙醇的结构特点和化学性质以及物理性质,应注意的是乙醇中-OH上的H原子和其它5个H原子不同,钠和乙醇能发生置换反应生成氢气.


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 某元素的一种核素的核内质子数为m,中子数为n,由此一定能确定该元素的近似相对原子质量为m+n | |
| B. | 短周期元素X、Y、Z,X的阳离子与Y的阴离子具有相同的电子层结构,Z的阴离子的还原性大于等电荷数Y的阴离子的还原性,那么原子序数大小是Z>X>Y | |
| C. | 第118元素在元素周期表中的位置是第七周期VIA族 | |
| D. | 碱金属单质的熔沸点和卤素单质的熔沸点都是随核电荷数的递增而升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁、铝分别与热水反应 | |
| B. | 镁、铝分别与盐酸反应 | |
| C. | 氯化镁溶液、氯化铝溶液分别与氢氧化钠溶液反应 | |
| D. | 将镁-铝-氢氧化钠溶液设计为原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
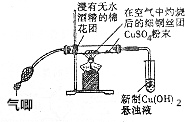 在完成“乙醇的催化氧化实验“后,某学校化学兴趣小组认为该实验方案存在着明显的缺点.
在完成“乙醇的催化氧化实验“后,某学校化学兴趣小组认为该实验方案存在着明显的缺点.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+8+m-n | B. | a+18-m+n | C. | a+32-m-n | D. | a+24-m-n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Al | Si | S | Cl | Ar |
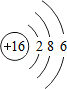 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
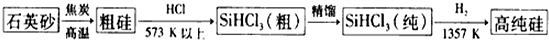
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com