
| A. | 可用足量Br2的四氯化碳溶液除去甲烷中的乙烯 | |
| B. | 蛋白质溶液中加入CuSO4溶液后,蛋白质析出,再加水不溶解 | |
| C. | 苯的硝化反应属于取代反应 | |
| D. | 往溴水中加入苯,振荡,溴水变为无色,说明苯与溴发生加成反应 |
科目:高中化学 来源: 题型:解答题
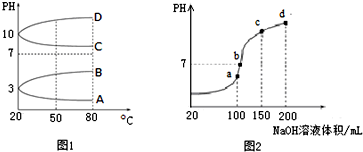
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
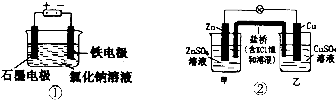
| A. | 装罝①两极均有气泡产生,滴人酚酞溶液后,石墨电极附近溶液变红 | |
| B. | 装置①电解一段时间,加人盐酸溶液可使电解质溶液恢复原状 | |
| C. | 装置②盐桥中的K+向乙池移动 | |
| D. | 装置②反应一段时间后,乙池中溶液的pH变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯的结构简式: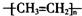 | B. | CH4分子的填充(或比例)模型: | ||
| C. | 乙醇的分子式:CH3CH2OH | D. | 8个中子的碳原子的核素符号:12C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molMg2+含有NA个电子 | |
| B. | 1mol•L-1的NaCl溶液中含有NA个Na+ | |
| C. | 2molCu与足量S加热充分反应,转移2NA个电子 | |
| D. | 4gCH4与Cl2在光照条件下反应全部转化为CCl4时,断裂NA个C-H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
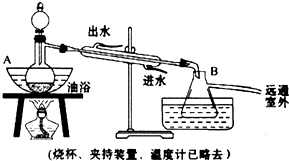 后静置,放出水层(废液).
后静置,放出水层(废液).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
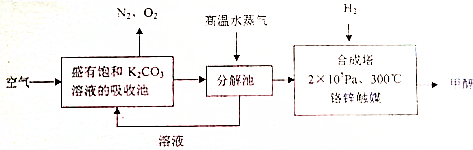
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
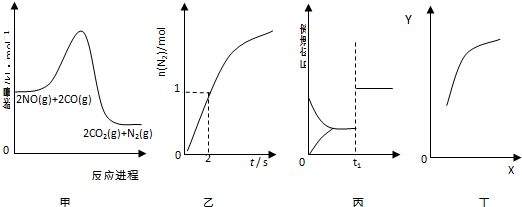
| A. | 由图象甲可知,该反应正反应为放热反应 | |
| B. | 由图象乙可知,0~2s内平均速率V(CO)=1mol•L-1•s-1 | |
| C. | 由图象丙可知,t1时改变的条件可能为增大压强 | |
| D. | 由图象丁中,若X为c(CO),则纵坐标Y可能为NO的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com